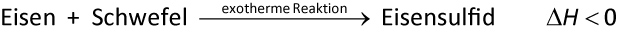2.2 Chemische Reaktion und Energie
a) Versuch
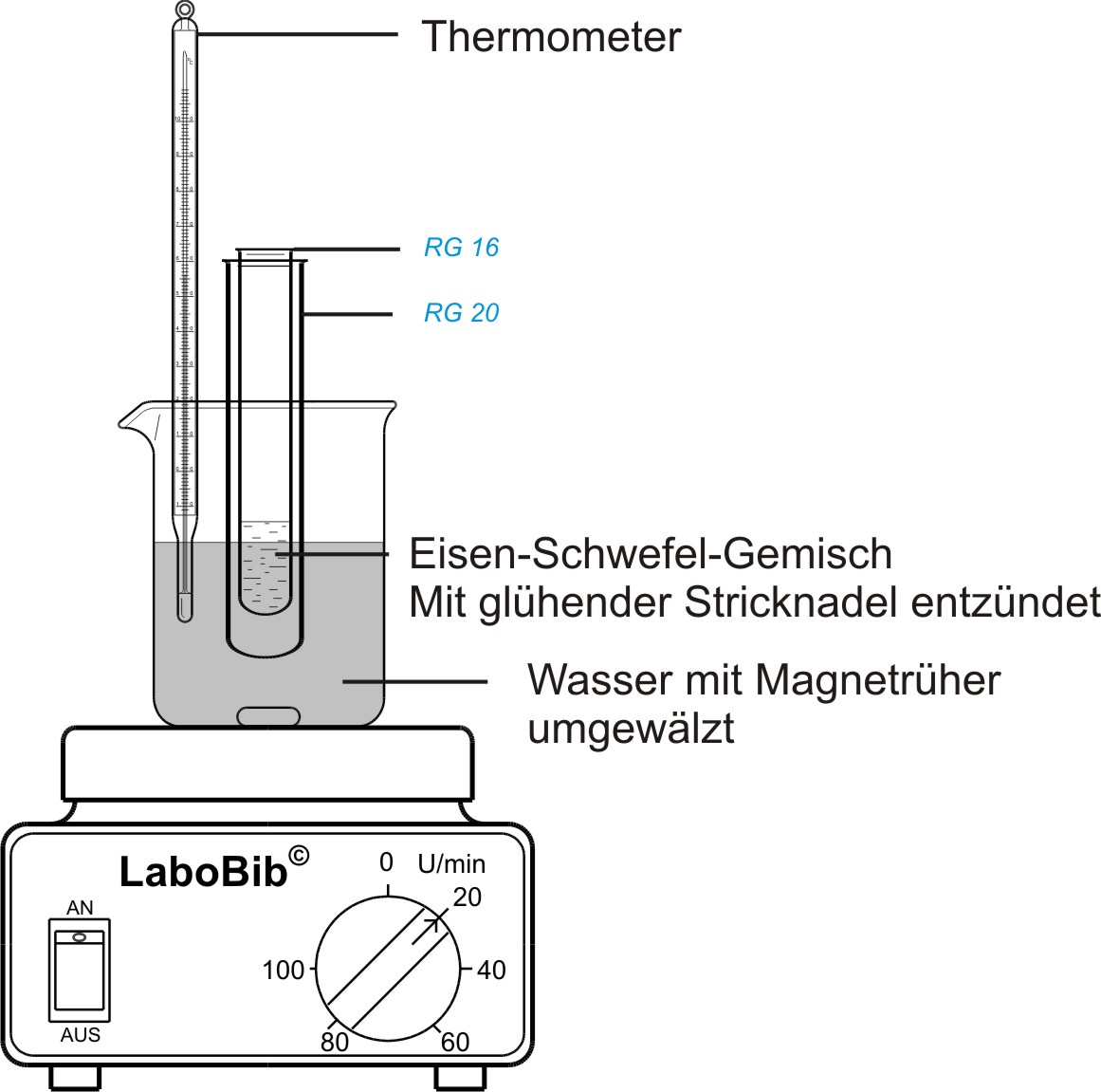
Bei dieser Reaktion gibt das reagierende System Energie ab: exotherme Reaktion
Erklärung
Das System (Gemisch der Ausgangsstoffe Eisen + Schwefel) hat einen bestimmten Energieinhalt (Enthalpie). Das Reaktionsprodukt (Eisensulfid) hat ebenfalls einen bestimmten Energieinhalt (Enthalpie), dieser ist jedoch kleiner als der des Ausgangsgemisches.
Die Energie wird nach außen abgegeben.
b ) Energiediagramm
(Enthalpiediagramm) für die chemische Reaktion Eisen + Schwefel
Die Enthalpie ist der Energieinhalt eines Stoffsystems. Man kann nur Enthalpiedifferenzen (ΔH) messen.
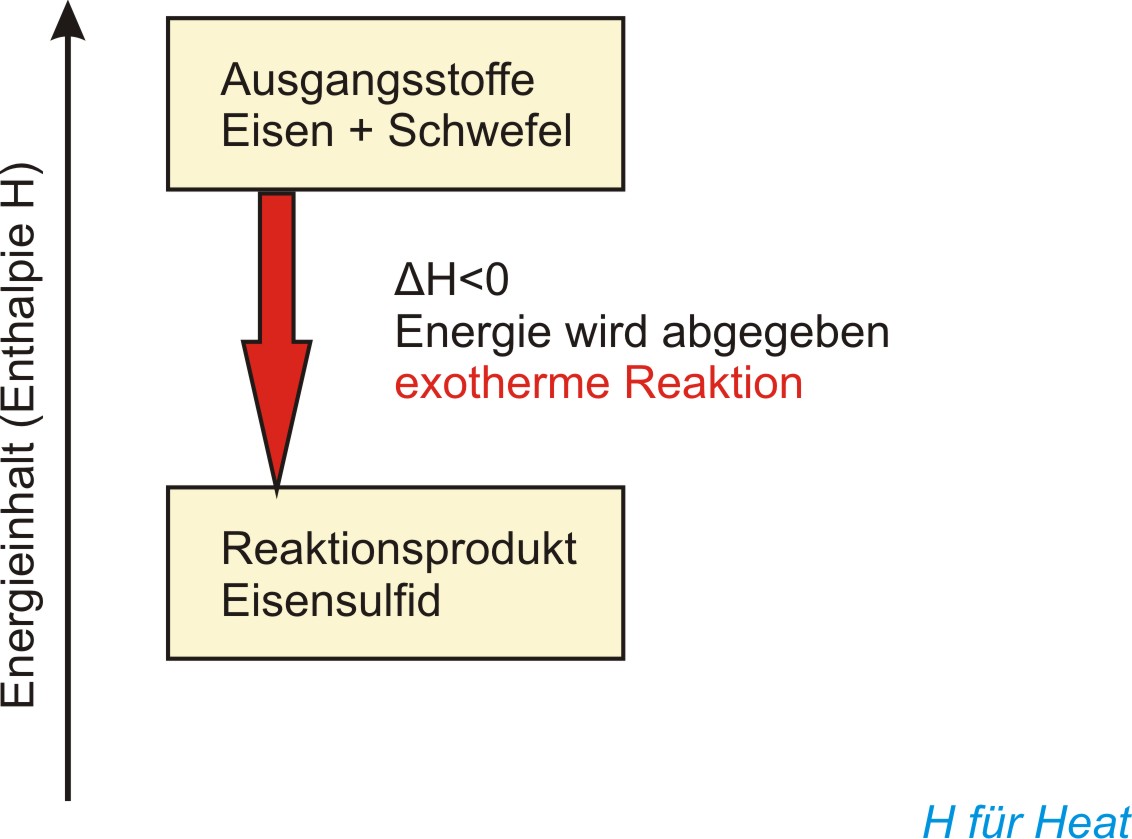
Berechnung für die Enthalpieänderung:
ΔH = H(Endprodukte) - H(Ausgangsstoffe)
Exotherme Reaktionen verlaufen unter Energieabgabe (ΔH < 0);
endotherme Reaktionen verlaufen unter Energieaufnahme (ΔH > 0).
c) Merke:
Chemische Reaktionen sind Vorgänge, bei denen Stoffe mit neuen Eigenschaften gebildet werden. Dabei wird Energie aufgenommen oder abgegeben.