Redoxreaktionen
1. Bildung von Ionenverbindungen bei Hauptgruppenelementen
1.1 Magnesium + Sauerstoff
Experiment: Magnesiumband wird an der Luft entzündet. Es brennt mit sehr heller Flamme.
a) Vereinfacht: Alle Elemente als Atome geschrieben.
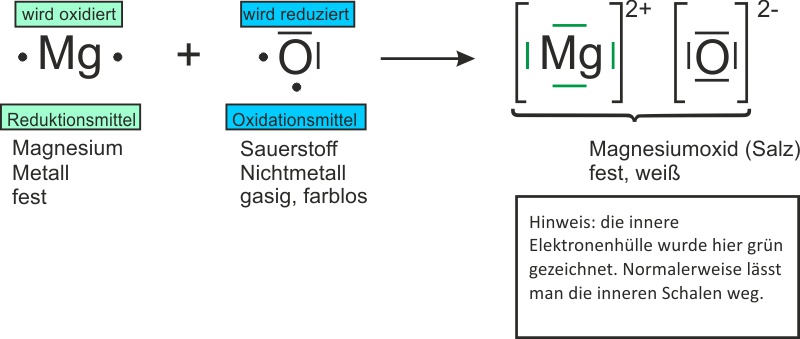
b) keine Vereinfachung: Sauerstoff wird als Molekül geschrieben:
Reaktionsgleichung: 2 Mg + O2 → 2 MgO ΔH < 0
c) Redoxschema:
I. Allgemein:
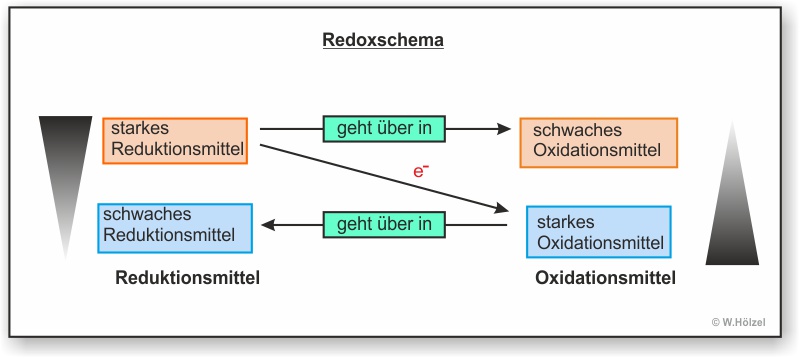
Hier erst mal das Redoxschema einer freiwillig ablaufenden Reaktion (Bergabreaktion). Mit Hilfe eines Redoxschemas kann man eine Reaktion veranschaulichen. Auf dem diagonalen Pfeil schreibt man die Anzahl der Elektronen, die von einem Stoff (bzw. Teilchen) zu einem anderen Teilchen übergehen. Oben links steht das Teilchen, welches die Elektronen abgibt. Wenn dieses Teilchen diese Elektronen abgibt verändert es sich selbst (Natrium ist zum Beispiel ein sehr reaktives Metall; Natrium-Kation hingegeben ist reaktionsarm und wir nutzen es als Bestandteil des Speisesalzs). Das oxidierte Teilchen wird oben rechts geschrieben.
Unten rechts steht das Teilchen, welches Elektronen aufnimmt. Auch dieses Teilchen verändert sich dabei. Das Ergebnis steht dann unten links.
II. Mg + O2
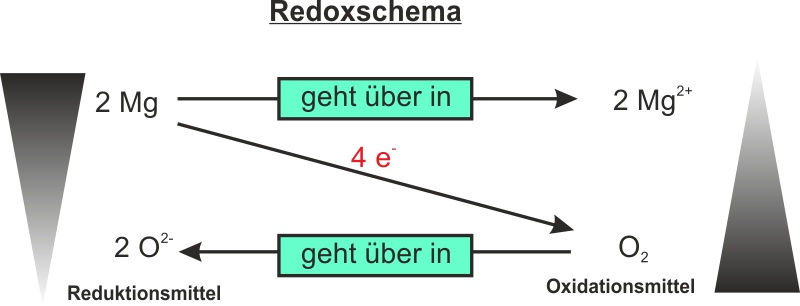
d) Teilgleichungen
Gerade bei komplizierten Redoxgleichungen, kann es eine Hilfe sein, dass man die Reaktionsgleichungen in die Teilreaktionen Oxidation und Reduktion aufsplittet. Das Ergebnis für die Verbrennung von Magnesium sind man in den folgenden Teilgleichungen. Da die Anzahl der aufgenommenen und abgegebenen Elektronen gleich sein muss, multipliziert man die Oxidationsreaktion mit zwei. Dadurch geben zwei Magnesium-Atome vier Elektronen ab (siehe Redox) und das Sauerstoffmolekül nimmt vier Elektronen auf.
Oxidation: Mg → Mg2+ + 2 e- | · 2
Reduktion: O2 + 4 e- → 2 O2- | · 1
---------------------------------------------------
Redox: 2 Mg + O2 → 2 Mg2+ + 2 O2-
