4.8 Moleküle
Def.: Moleküle sind kleinste Teilchen, die aus zwei oder mehreren Atomen zusammengesetzt sind.
Viele Reinstoffe (Verbindungen, z.B. Wasser, Kohlenstoffdioxid) bestehen aus Molekülen.
a) Molekülformel
Bsp.: Die Molekülformel H2O sagt folgendes aus: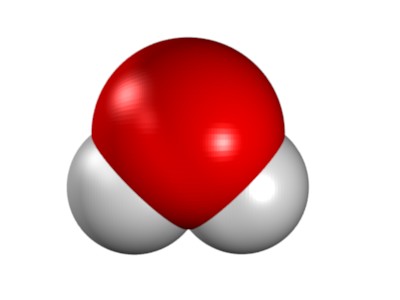
Ein Molekül Wasser besteht aus 2 Atomen Wasserstoff und 1 Atom Sauerstoff.
Allgemein: Die Molekülformel gibt Art und Anzahl der Atome im Molekül an.
Kennt man die Verhältnisformel (vgl. oben) einer Verbindung, so sind beliebig viele Molekülformeln möglich:
Bsp.: Atomanzahlverhältnis N(H) : N(O) = 2:1 => theoretisch mögliche Formeln: H2O1; H4O2;...
=> Genauere Untersuchung gibt die exakte Molekülformel.
b) Molekülmasse
Die Molekülmasse ist die Masse eines Moleküls in u. Die Molekülmasse ist somit gleich der Summe der Massen der im Molekül enthaltenen Atome.
Beispiele:
1. Bestimme die Molekülmasse vom Molekül Kohlenstoffdioxid (CO2)!
O2: 2 • 16 u
C: +12 u
CO2: 44 u
2. Bestimme die Molekülmasse von Wasser (H2O).
Lösung: Die Molekülmasse beträgt 18 u.
c) Molare Masse bei Molekülen
Die molare Masse ist die Masse von 1 mol eines Stoffes.
Der Zahlenwert der molaren Masse ist gleich dem Zahlenwert der Atommasse (bei Atomen) bzw. der Summe der Atommassen (Verbindungen).
Bsp.: M(H2O) = 2 • 1 g/mol + 16 g/mol = 18 g/mol
M(CO2) = 44 g/mol