4 Allgemeine Säure-Base-Definition nach Brønsted (1923)
a) Säuren...
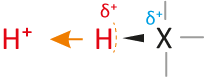
... sind Teilchen, die Protonen abgeben können (= Protonendonator, „Protonenspender“).
Die Teilchen enthalten positivierte H-Atome (Die Bindung zum H-Atom muss polar sein):
Wasserstoffatome bestehen nur aus Protonen und Elektronen. Eine Säure besitzt ein Wasserstoffatom, wobei das Elektron von dem Wasserstoffatom „stark“ angezogen wird. Kommt es zu einer Säure-Base-Reaktion (Protolyse), dann wird vereinfacht ausgedrückt nur das Proton des Wasserstoffatoms abgegeben. Das Elektron der Wasserstoffatoms bleibt beim Teilchen zurück (vgl. dazu alle vorher genannten Beispiele).
b) Basen...
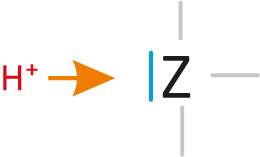
sind Teilchen, die Protonen aufnehmen können (= Protonenakzeptor, „Protonenräuber“). Die Teilchen enthalten mindestens ein freies Elektronenpaar.
Dieses freie Elektronenpaar „nimmt“ dann den positiven Wasserstoffkern (Proton) „auf“.
c) Übung
Im folgenden ist die Lewis-Formel (Strukturformel) von Wasser abgebildet. Gehört dieses Molekül zu einer Brønsted-Säure oder -Base? Schaut Euch dafür nochmals die Definitionen an.
{slider title="Lösung: Was ist Wasser? Eine Säure oder Base?" open="false" class="icon"}
Wasser kann (je nach Reaktionspartner) beides sein. Es kann ein Proton (H⁺) abgeben [es hat ja positivierte Wasserstoff-Atome], wie auch aufnehmen [es hat ja auch freie Elektronenpaare].
Dafür gibt es eine neue Bezeichnung: Wasser ist ein Ampholyt.
{/sliders}
c) Ampholyte
Ampholyte können sowohl als Säuren, wie auch als Basen reagieren. Sie müssen also freie Elektronenpaare (für die Funktion als Basen) wie auch positivierte Wasserstoff-Atome (Funktion als Säure) besitzen.