4.7.3 Beispiele für Elektrochemische Korrosionen
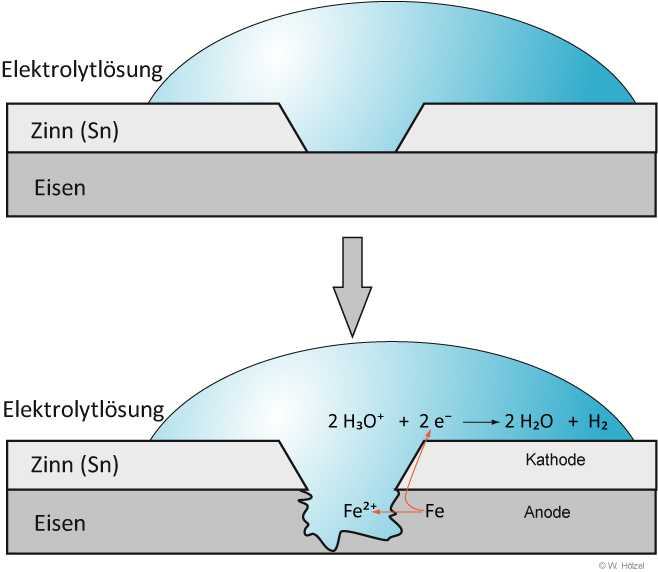
I. Lokalelement bei verzinntem Eisenblech/Stahlblech = „Weißblech“ (Getränkedosen)
Ist der Zinnüberzug beschädigt, kommt es zu folgenden Reaktionen:
Überlegt Euch mit Hilfe der Tabelle welche Reaktionen möglich sind:
{slider title="Lösung" open="false" class="icon"}
Anode: Fe → Fe²⁺ + 2 e⁻
Kathode: 2 H₃O⁺ + 2 e⁻ → H₂ + 2 H₂O
Gesamt: Fe + 2 H₃O⁺ → Fe²⁺ + H₂ + 2 H₂O
Durch die Beschädigung des Sn-Überzugs entsteht ein kurzgeschlossenes galvanisches Element.
Das unedle Metall (hier Eisen) wird dabei anodisch oxidiert. Eine Weißblechdose rostet viel schneller und zersetzt sich.
{/sliders}
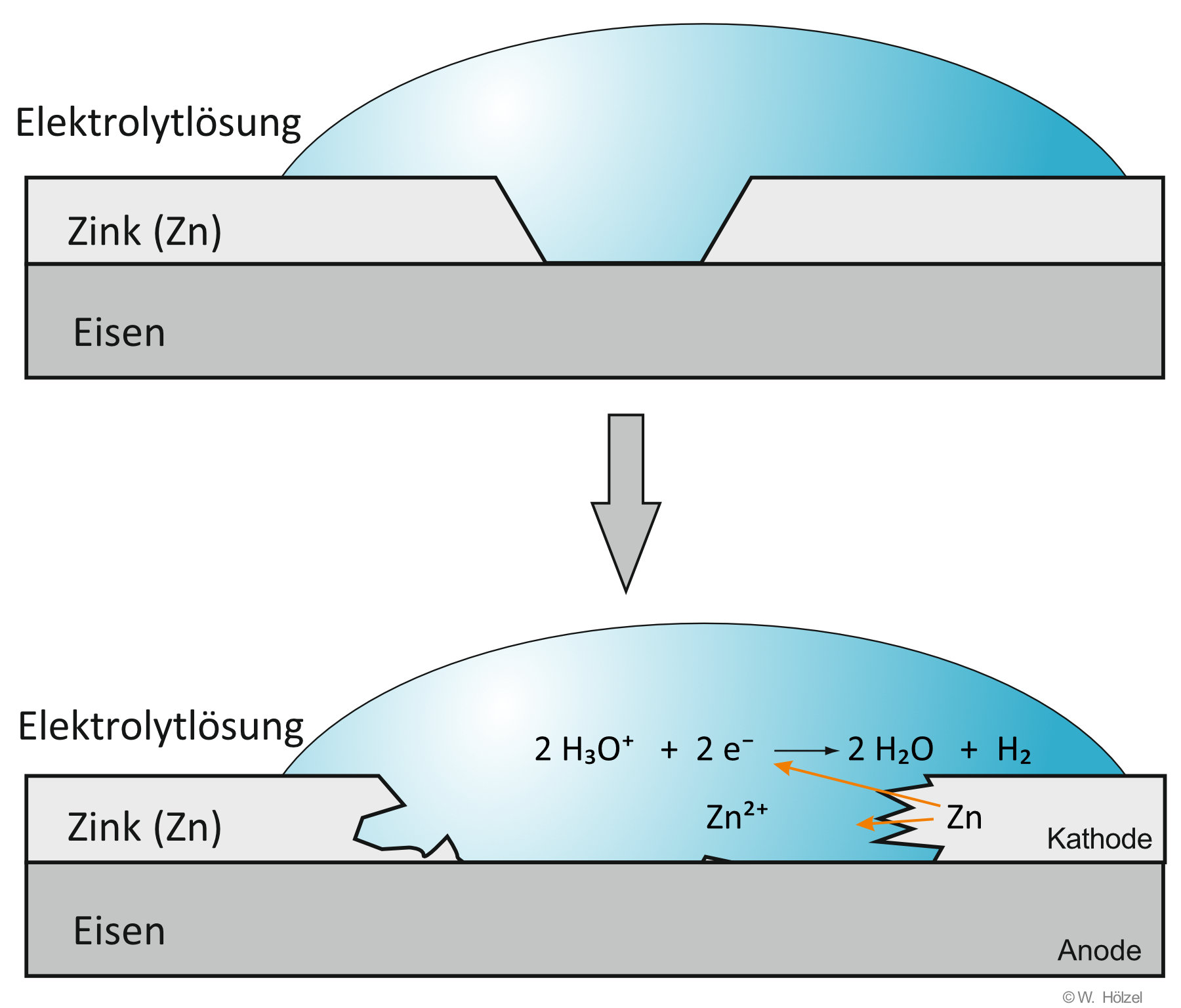
II. Lokalelement bei verzinktem Eisenblech/Stahlblech (Autokarosserien)
Ist der Zn-Überzug beschädigt, so kommt es zu folgenden Reaktionen:
Überlegt Euch mit Hilfe der Tabelle welche Reaktionen möglich sind:
{slider title="Lösung" open="false" class="icon"}
Anode: Zn → Zn²⁺ + 2 e⁻
Kathode: 2 H₃O⁺ + 2 e⁻ → H₂ + 2 H₂O
Gesamt: Zn + 2 H₃O⁺ → Zn²⁺ + H₂ + 2 H₂O
Durch die Beschädigung des Zn-Überzugs entsteht ein kurzgeschlossenes galvanisches Element.
Das unedle Metall (hier Zink) wird dabei anodisch oxidiert.
{/sliders}
Anwendung: Verzinkte Bleche,
Opferanode: Eine Opferanode ist ein Block aus einem elektrochemisch „unedlen“ Metall. Sie ist elektrisch leitend mit den zu schützenden („edleren“) Metallen verbunden. In wässriger Umgebung bilden die beiden Metalle ein Lokalelement, bei dem sich die Opferanode auflöst (sich also gewissermaßen „opfert“) und dadurch das edlere Metall vor Korrosion bewahrt. (Zitat wiki).