13 Metastabile Zustände
Metastabile Zustände, physikalische oder chemische Zustände eines Stoffes, die nur einen sehr kleinen Anstoßes bedürfen, um sofort in stabile Zustände überzugehen.
Exergonische Reaktionen, die stark gedrosselt sind (d.h. es findet fast kein Stoffumsatz statt), bezeichnet man als metastabil (zu geringe Reaktionsgeschwindigkeit)
Beispiele:
- Knallgasgemisch (Wasserstoff-Sauerstoff-Gemisch → Wassersynthese)
- Chlorknallgasgemisch (Chlor-Wasserstoff-Gemisch → Chlorwasserstoffsynthese)
- Stickstoff-Wasserstoff-Gemisch → Ammoniaksynthese
- Benzin-Luft-Gemisch
Die Überführung solcher metastabiler Zustände in stabile Zustände kann durch Katalysatoren beschleunigt werden.
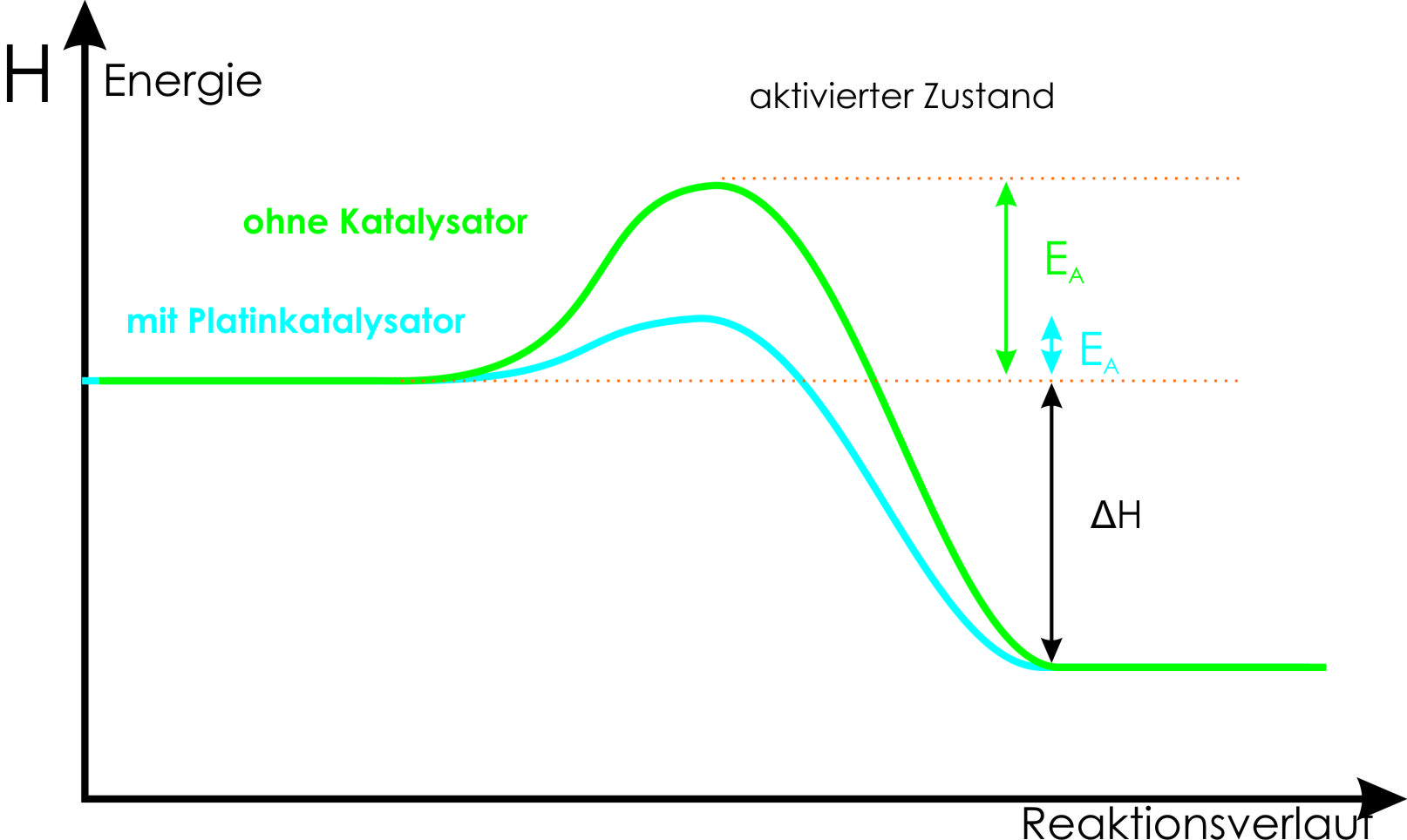
Def. Katalysator: Stoff, der eine Reaktion bei niedriger Reaktion ermöglicht oder beschleunigt (durch Herabsetzung der Aktivierungsenergie) und danach unverändert vorliegt. Ein Katalysator greift in eine Reaktion ein, indem er ihren Ablauf (Reaktionsmechanismus) verändert. Die Aktivierungsenthalpie einer katalysierten Reaktion ist immer niedriger als die Aktivierungsenthalpie einer nicht katalysierten Reaktion.
Bsp.: Kaliumchlorat
2 KClO₃ → KClO₄ + KCl + O₂
Folgende Schemata ergeben sich für einen katalysierten Vorgang der einfachen Reaktion:
Ohne Katalysator: A + B → C
Mit Katalysator: A + K → AK
AK + B → C + K
(K steht für einen Katalysator).
a) Homogene Katalyse
Hier liegt der Katalysator im gleichen Aggregatzustand (gleiche Phase) vor wie das katalysierte System.
Bsp.: Sehr viele chemische Reaktionen werden durch den Zusatz von Säuren oder Basen katalysiert; z.B. Umwandlung von Alkoholen zu Halogenalkanen.
Br¹⁻ + C₂H₅OH → C₂H₅Br + OH⁻
Bzw. HBr + C₂H₅OH → C₂H₅Br + H₂O
b) Heterogene Katalyse
Hier liegt der Katalysator in einem anderen Aggregatzustand (Phase) vor wie das katalysierte System. Bei der heterogenen Katalyse muss mindestens ein Reaktionspartner an die Katalysatoroberfläche adsorbiert werden.
Bsp.: Entzündung von H₂-Gas bei Zimmertemperatur mit Platin.
c) Enzymatische Katalyse
Katalysatoren in der lebenden Zelle sind die Enzyme. Diese Enzyme sind Eiweißstoffe, die die Aktivierungsenergie spezieller Reaktionen in einer Zelle absenken, damit bei Körpertemperatur chemische Reaktionen überhaupt ablaufen. Diese Enzyme sind hoch spezialisiert. Unwirksam werden sie bei höherer Temperatur (ab 42°C), Säuren und durch zahlreiche Metallionen.