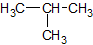Hinweis: 1.2 Ethan und 1.3 Propan wird nur bei ausreichend Zeit und entsprechend vorrätigen Chemikalien als einzelne Punkte besprochen. Da es aber sowieso ähnlich ist, wird an dieser Stelle auf den Heftaufschrieb verzichtet (vgl. weiter unten: Homologe Reihe).
1.4 Butan
1.4.1 Vorkommen
im Erdgas, fällt an bei der Benzingewinnung
1.4.2 Eigenschaften
farbloses Gas, größere Dichte als Luft
brennbar (Verbrennungsprodukte bei vollständiger Verbrennung: CO2 und H2O )
unter Druck leicht verflüssigbar
1.4.3 Ermittlung der Summenformel (Molekülformel) und Strukturformel
a) Qualitative Analyse (Elementaranalyse)
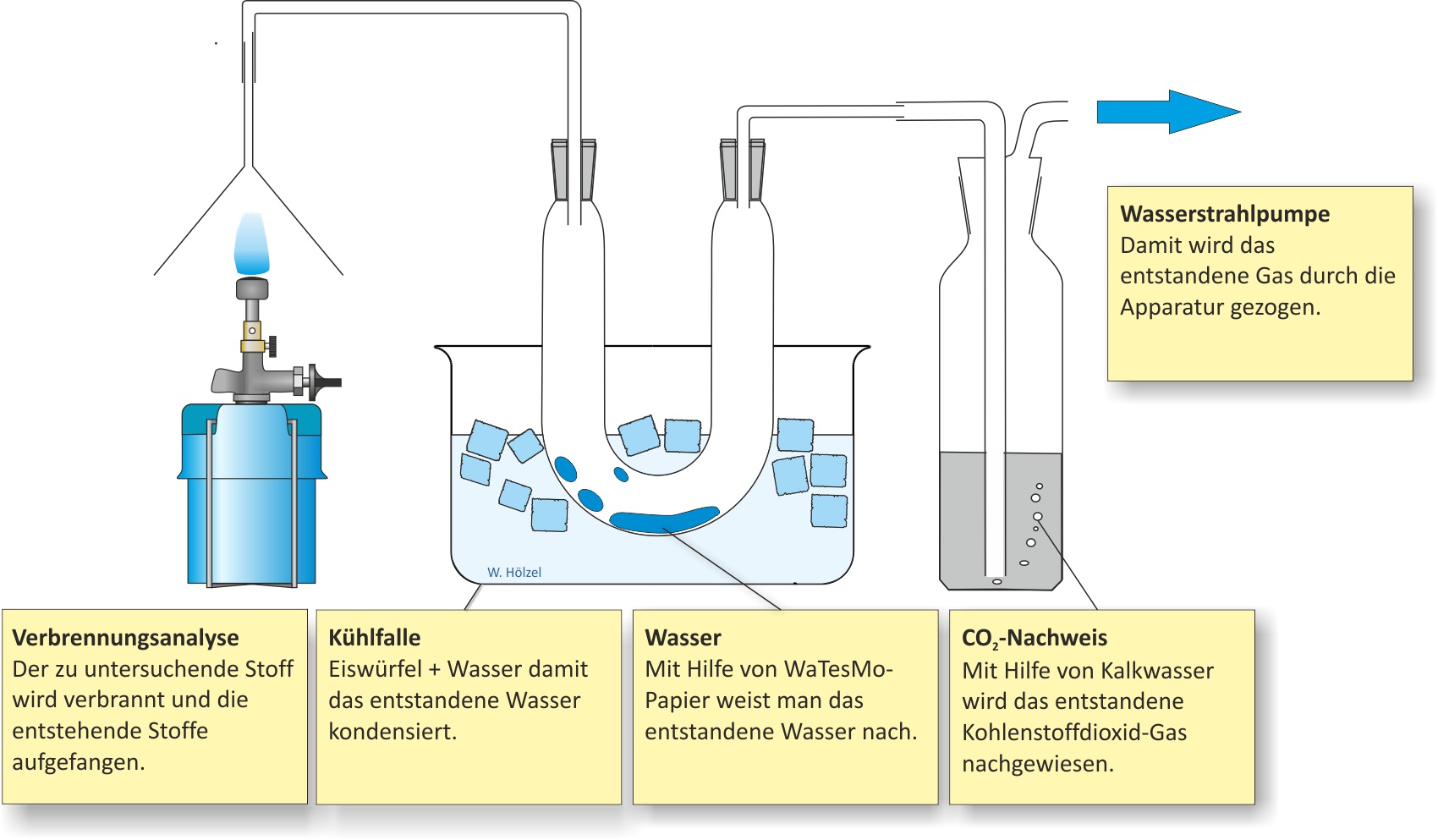
Die Verbrennungsprodukte (Wasser, Kohlenstoffdioxid) ergeben, dass Methan Kohlenstoff, Wasserstoff und eventuell Sauerstoff enthält
b) Bau und Formeln
1. Molare Masse = 58,12 g/mol
Molekülmasse = 58,12 u
2. Summenformel:
C4H10
3. Strukturformel:
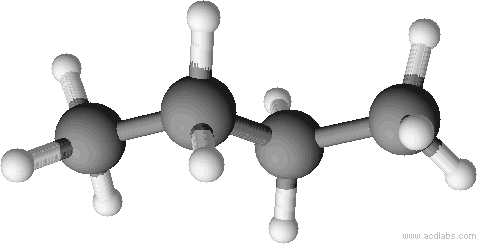
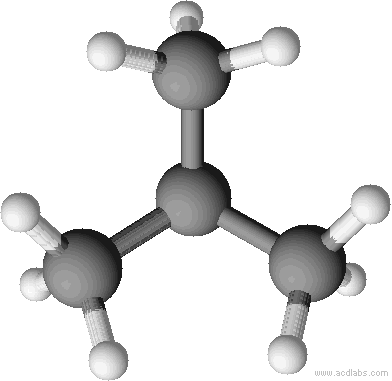
a) unverzweigte Kette b) verzweigte Kette

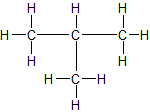
n-Butan Isobutan = 2-Methyl-Propan
Sdp.: - 0,5 °C Sdp.: - 12 °C
ZMK: nur van-der-Waals-Kräfte; bei n-Butan können sich die Moleküle dichter zusammenlagern und haben dadurch stärkere Zwischenmolekulare Kräfte, d.h. eine etwas höhere Siedetemperatur.
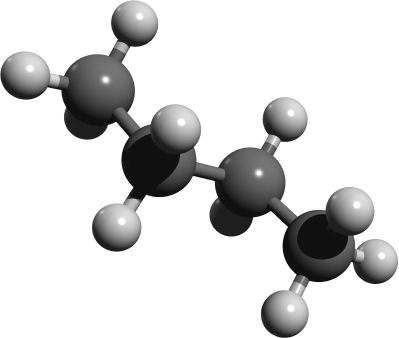
Räumliche Strukturen im Kugelstabmodell. Versucht die einzelnen Abbildungen Isobutan oder n-Butan zuzuordnen. Der Vorteil von Kugelstabmodelle sind, dass sie die Bindungen und Bindungswinkel anschaulich darstellen.
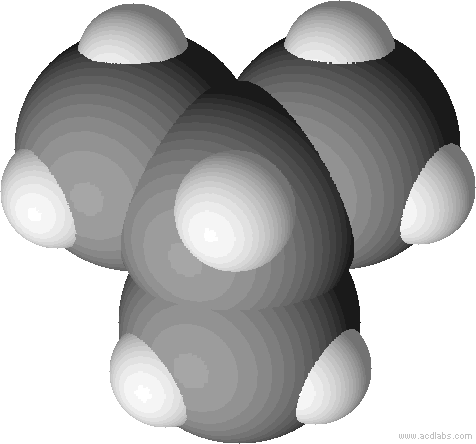
Kalottenmodell von 2-Methyl-Propan (= Isobutan). Bei Kalottenmodellen wird die Raumfüllung deutlich.
Da Strukturformeln bei größeren Molekülen zu lange dauern, hilft man sich mit der Halbstrukturformel aus, wobei die Wasserstoffatome quasi als Summenformel hinter das C geschrieben wird. Man schaut zunächst, wie viele Bindungen ein C schon hat und füllt dann mit so vielen H-Atomen auf, bis die Vierbindigkeit von Kohlenstoff erfüllt ist. Hier am Beispiel von Isobutan.
1.4.4 Verwendung
Heizgas („blaue Gaskartuschen“), Kältemittel (Ersatz für FCKW), Treibgas in Sprays, Feuerzeuggas (häufig zusammen mit Propan)
1.4.5 Isomerie
(isos (griech.) = gleich; meros (griech.) = Teil)
Verbindungen, deren Moleküle bei gleicher Summenformel unterschiedliche Strukturformeln besitzen, bezeichnet man als Isomere. Isomere Verbindungen unterscheiden sich vor allem in ihren physikalischen Eigenschaften (Schmelz- und Siedepunkt) und wenig in ihren chemischen Reaktionen.
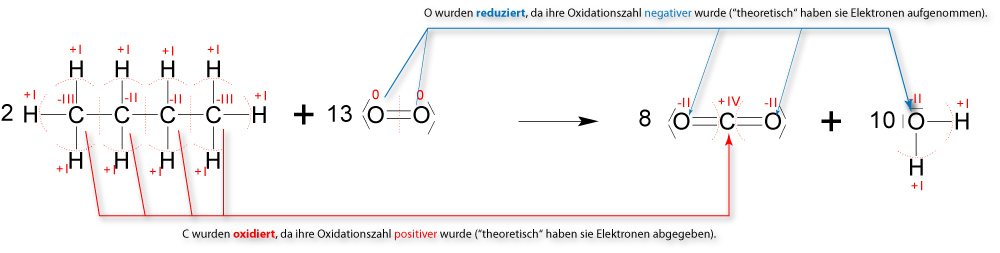
1.4.6 Vollständige Verbrennung (Oxidation)
Wenn Butan vollständig verbrannt (oxidiert) wird, so entsteht dabei ausschließlich Kohlenstoffdioxid und Wasser.