Metallische Bindung
Die metallische Bindung wird leider nicht ausführlich im Unterricht angesprochen. Trotzdem hilft ein rudimentäres Verständnis dieser Bindung die Vorgänge in der Elektrochemie zu verstehen. Wobei ich für ein richtiges Verständnis der metallischen Bindung an dieser Stelle (nochmals leider) auf die Universität bzw. Literatur verweisen muss.
a) Das Elektronengasmodell
Metalle geben die Valentzelektronen (Außenelektronen) leicht ab (d.h. sie besitzen eine geringe Ionisierungsenergie). Das Elektronengasmodell geht davon aus, dass die Valenzelektronen der Metallatome ein frei bewegliches „Elektronengas“ zwischen den Atomrümpfen (Atomrümpfe = Atom ohne Außenelektronen) bilden. Dieses „Elektronengas“ hält die positiven Atomrümpfe im Metallgitter zusammen und ist leicht beweglich (deshalb die gute elektrische Leitfähigkeit).
b) Die elektrochemische Doppelschicht
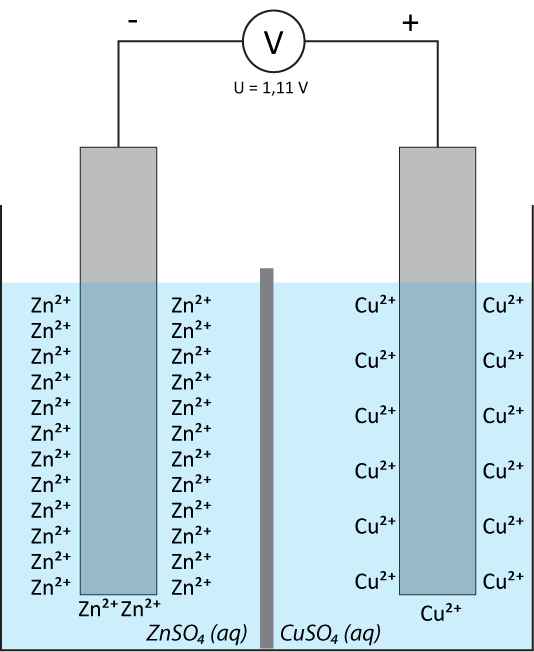
Der Elektronenfluss in einer galvanischen Zelle wird durch eine Spannung zwischen den Elektroden hervorgerufen. An der Phasengrenze der Elektroden (z.B. Übergang zwischen Zinkmetall und Zink-Ionen) treten durch die Phasengrenze fest/flüssig ständig Metall-Ionen in beide Richtungen hindurch.
Zunächst überweigt die Abgabe der Metall-Ionen aus dem festen Metall. Dabei bleiben die Valenzelektronen in der Elektrode (feste Phase) zurück und lädt diese Elektrode gegenüber der Lösung negativ auf. Diese negative Aufladung führt dazu, dass vermehrt positive Ionen aus der Lösung wieder angezogen werden, was zu einem elektrochemischen Gleichgewicht führt: pro Zeiteinheit treten dann gleich viele Ionen in beiden Richtungen durch die Phasengrenze. Dabei entsteht an der Phasengrenze entsteht eine elektrische Doppelschicht aus negativen und positiven Ladungsträgern.
Nernst beschrieb diese Vorgänge anschaulich als Gleichgewicht zwischen dem Lösungsdruck (also die Abgabe der Metall-Ionen aus der festen Phase) und dem Abscheidungsdruck (die Aufnahme der Metall-Ionen an der Elektrode) eines Metalls.
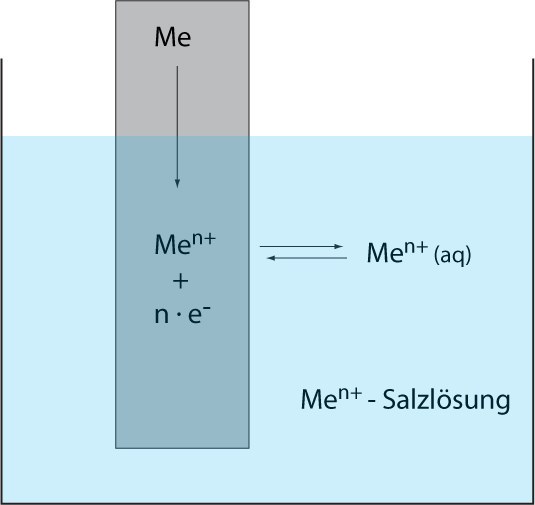
Wichtig für die Vorgänge in einer Halbzelle sind:
- Im Metall sind bereits Ionen vorhanden (die Atomrümpfe), eingebettet in das „Elektronengas“ (metallische Bindung)
- Der Lösungsdruck wird umso größer sein, je kleiner die Gitterenergie (Metall), je kleiner die Ionisierungsenergie und je größer die Hydrationsenergie ist (Ionen in wässriger Lösung!). Zusätzlich wird eine geringe Ionenkonzentration in der Lösung den Lösungsdruck (die Lösungstendenz) erhöhen).
- Gitterenergie = Arbeit, die man verrichten müsste um die Metallteilchen (oder Ionen,...) unendlich weit voneinander zu entfernen;
- Ionisierungsenergie = Energie, die man benötigt um ein Elektron vom zu entfernen und ein Ion zu bekommen;
- Hydrationsenergie = Energie, die frei wird, wenn sich Wassermoleküle um ein Ion (oder polares Molekül) lagern (Hydrathülle ausbilden).
- großer Lösungsdruck dann, wenn z.B. Metallatome im Gitter nur schwach angezogen werden und diese gerne Elektronen abgeben.
Im folgenden Beispiel haben Zink- und Kupferhalbzellen ein unterschiedliche Lage des elektrochemischen Gleichgewichts, was zu einer Potentialdifferenz führt: Zink geht leichter in Lösung und gibt dabei seine Elektronen ab, Kupferionen scheiden sich leichter an der Kupferelektrode ab.