4.2 Bleiakkumulator (1859, Gaston Planté)
Vgl. AB
Versuch 1
Herstellung: Man taucht zwei Bleiplatten in 20%-ige Schwefelsäure (H₂SO₄). Die beiden Bleiplatten überziehen sich mit einer weißen Schicht.
Erklärung: Blei (Pb) steht in der Spannungsreihe über dem Wasserstoff, somit läuft zunächst folgende Redox-Reaktion ab:
Formuliert die Reaktionsgleichung (nutzt -sofern vorhanden- die Tabelle des Standardelektrodenpotentials:
{slider title="Lösung" open="false" class="icon"}
Pb (s) + 2 H₃O⁺ (aq) + SO₄²⁻(aq) → PbSO₄ (s) ↓ + H₂ (g) + H₂O (l)
Die Pb²⁺-Ionen bilden sofort mit den SO₄²⁻-Ionen das schwerlösliche Salz Bleisulfat (PbSO₄). Dieses weiße, schwerlösliche Bleisulfat überzieht die beiden Bleiplatten; die Redox-Reaktion kommt zum Stillstand.
{/sliders}
Jetzt tauen zwei gleiche Elektroden in den gleichen Elektrolyten (Schwefelsäure), somit besteht keine Spannung zwischen den Elektroden.
Die Aufladung des Bleiakkus erfolgt durch Elektrolyse.
Versuch 2: Aufladung
Möglicher Versuchsaufbau:
Merke: An der Anode (+ Pol) spielt sich die Oxidation, an der Kathode (- Pol) die Reduktion ab.
Formuliert mögliche Teilreaktionen:
{slider title="Lösung" open="false" class="icon"}
Oxidation (+Pol): Pb²⁺ + 2 H₂O → PbO₂ + 4 H⁺ + 2 e⁻ Es scheidet sich festes PbO₂ (Salz aus Pb²⁺ und O²⁻-Ionen aufgebaut) ab, die Schwefelsäure wird „konzentrierter“.
Reduktion (-Pol): Pb²⁺ + 2 e⁻ → Pb Es scheidet sich auf der Elektrode schwammi-ges Blei ab.
{/sliders}
Ergänzt einmal die Pfeile beim Ladungsvorgang
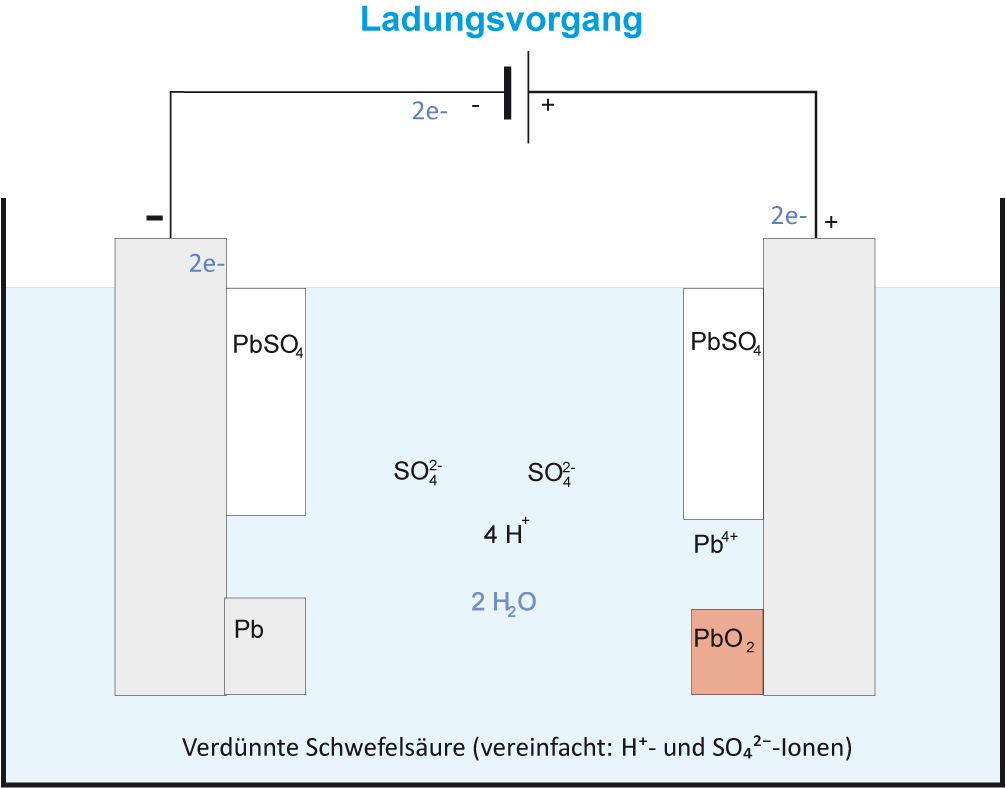
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Formuliert mögliche Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Gesamtreaktion beim Laden:
Pb²⁺ + 2 H₂O → Pb + PbO₂ + 4 H⁺
2 PbSO₄ + 2 H₂O → Pb + PbO₂ + 4 H⁺ + 2 SO₄²⁻
{/sliders}
Nun tauchen zwei verschiedene Elektroden (Pb und PbO₂ ) in die Elektrolytlösung. Zwischen diesen beiden Elektroden besteht eine Spannung von etwa 2 Volt. Der Bleiakku besteht im geladenen Zustand aus einer schwammig porösen Blei-Elektrode und einer rotbraunen Blei(II)-oxid-Elektrode. Als Elektrolyt dient 20-30%ige Schwefelsäure.
Versuch 3: Entladung
Formuliert auch für die Entladung die Teilreaktionen und die Gesamtreaktion:
{slider title="Lösung" open="false" class="icon"}
Oxidation (- Pol) Anode: Pb → Pb²⁺ + 2 e⁻ Die Anode überzieht sich mit schwerlöslichen Bleisulfat (PbSO₄ )
Reduktion (+ Pol) Kathode: PbO₂ + 4 H⁺ + 2 e⁻ → Pb²⁺ + 2 H₂O Die Kathode überzieht sich ebensfalls mit schwerlöslichem Bleisulfat (PbSO₄).
Gesamtreaktion beim Entladen:
Pb + PbO₂ + 4 H⁺ → 2 Pb²⁺ + 2 H₂O
Pb + PbO₂ + 4 H⁺ + 2 SO₄²⁻ → 2 PbSO₄ + 2 H₂O
{/sliders}
Abschließend: Wie müssten die Pfeile beim Entladevorgang verlaufen?

{slider title="Lösung" open="false" class="icon"}
{/sliders}



