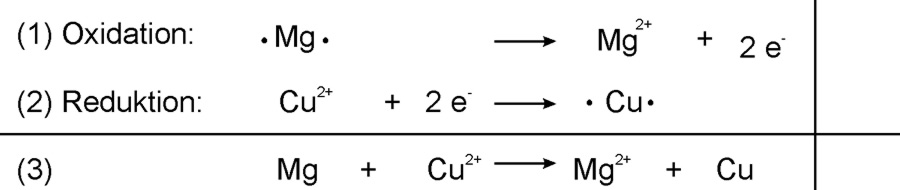2 Bildung von Ionenverbindungen mit Nebengruppenelementen
Je nach Reaktionspartnern reagieren die folgenden Mischungen unterschiedlich heftig. Mit Hilfe weiterer solcher Reaktionen kann man eine Reihe aufstellen (Redoxschema), welche Mischungen heftiger, welche weniger heftig oder gar nicht reagieren.
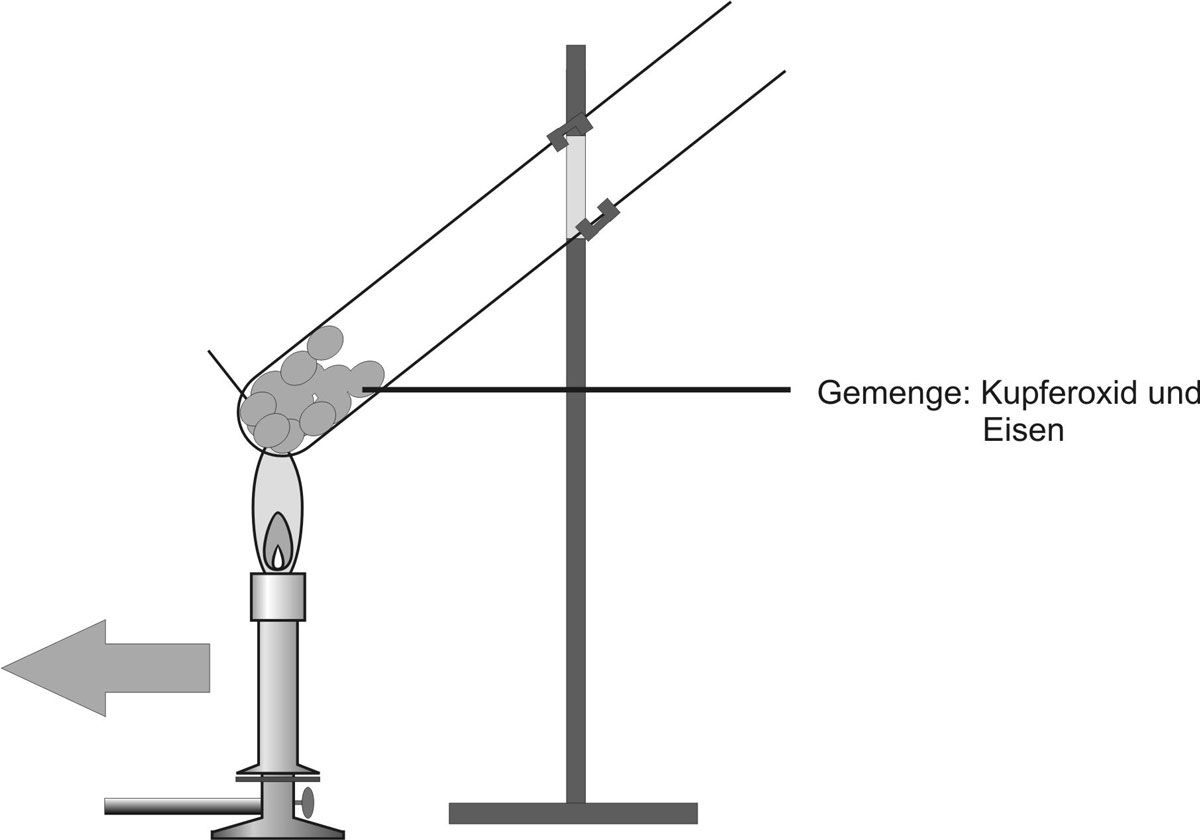
2.1 Kupferoxid + Eisen
Im Folgenden ist das Experiment dargestellt:
Teilreaktionen:
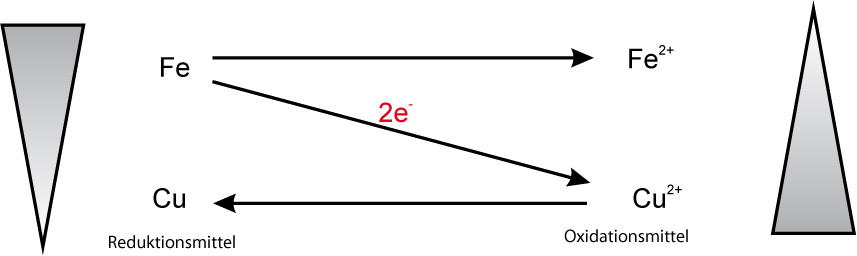
Teilchengleichung: Fe + Cu²⁺O²⁻ → Fe²⁺O²⁻ + Cu
Redoxschema:
Reaktionsgleichung:
| Fe | + | CuO | → | FeO | + | Cu | ΔH | < | 0 |
| Eisen | Kupfer(II)-oxid | Eisen(II)-oxid | Kupfer | ||||||
| Metall | Salz | Salz | Metall | ||||||
| grau | schwarz | weiß | rot-braun | ||||||
| Atom | Ionen | Ionen | Atom |
2.2 Kupferoxid + Magnesium
Zum Schluss Kupferoxid ist ein Salz (Ionenverbindung) und besteht aus Cu²⁺-Ionen und O²⁻-Ionen (Oxid-Ionen)
Formuliert die Oxidation, Reduktion, Redoxreaktion, Redoxschema und Reaktionsgleichungen.
Lösung
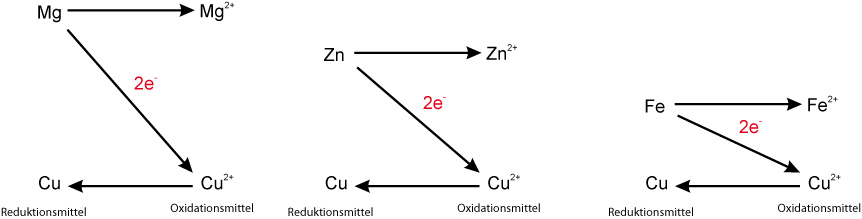
Reduktions- und Oxidationsfähigkeit im Vergleich:
Mit Hilfe der Redoxschemata könnte man angeben, wie heftig eine Reaktion verläuft. Je größer der Abstand ist, desto stärker die Reaktion:
Eine noch praktischere Anwendung ist, sämtliche Redoxpaare in ein Diagramm zu schreiben:
Mit Hilfe dieses Diagramms kann man z.B. Voraussagen machen, ob eine Reaktion (freiwillig) abläuft oder nicht.
Haben wir z.B. ein Gemisch aus Eisenpulver (Fe) und Kupfer-Ionen (Cu²⁺), dann verbindet man diese beiden Teilchen im Diagramm. Da nur die linken Teilchen (Reduktionsmittel) Elektronen abgeben können, ergibt sich daraus eine "Bergab-Reaktion"; die Reaktion verläuft also freiwillig (wenn man Aktivierungsenergie zuführt).
Hätte man hingegen ein Gemisch aus Kupfer (Cu) und Eisen-Ionen (Fe²⁺), dann müssten die Kupferteilchen die Elektronen abgeben (steht ja links). Verbindet man nun diese beiden Teilchen ergibt sich eine Diagonale von links unten nach rechts oben. Hier liegt also eine "Bergauf-Reaktion" vor; der Vorgang findet nicht freiwillig statt.
Solche Diagramme sind wirklich sehr praktisch und man bekommt sie sogar zum Chemieabitur, was den Vorteil hat, dass man -sofern man die Redox-Schemata verstanden hat- relativ schnell die Lösungen einfach abschreiben kann. Diese Diagramme werden ausführlich (zusammen mit dem Elektrodenpotential) in der Oberstufe (Thema Elektrochemie) besprochen. Hier schon einmal der Link (auch zu einer solchen ausführlichen Tabelle: 2.5 Elektrochemische Spannungsreihe der Metalle und 2.5.2 Anwendung der Spannungsreihe