4.4 pH-Wert unterschiedlich starke Säuren
HA + H₂O ⇌ A¹⁻ + H₃O⁺
• c(H₂O ) = konst.
• c₀ = Ausgangskonzentration.
• c(H⁺) = c(A¹⁻) Vernachlässigung der Autoprotolyse (für c₀(HA) ≥ 10⁻⁶ mol/l (Eigendissoziation des Wassers))
Exkurs
Falls euch folgendes schwerfällt, schaut nochmals im Kapitel der Gleichgewichtchemie nach; dort wurde es schon einmal behandelt.
c) Allgemein HA + H₂O ⇌ A¹⁻ + H₃O⁺
c(H⁺) = c(A¹⁻) = x
| HA | ⇌ | A¹⁻ | + H⁺ | |
| Ausgangsk. | c₀(HA) | 0 | 0 | |
| Im GG | c₀(HA) – c(H⁺) | c(H⁺) | c(H⁺) | |
| c₀ – x | x | x |

![]()
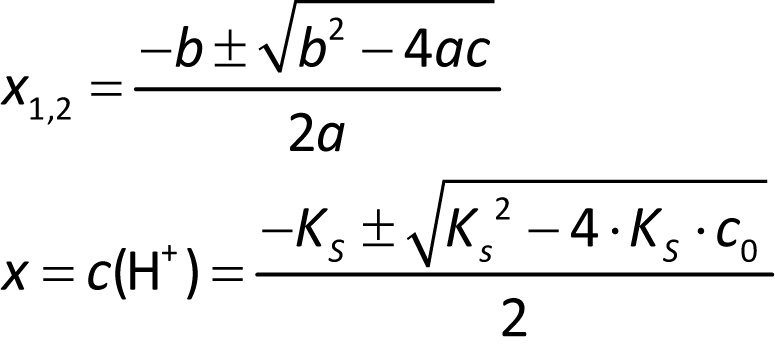
a) sehr starke Säuren (pKS < -1,74) und Basen (pKB < -1,74)
Sehr starke Säuren reagieren vollständig mit Wasser.
(Oxoniumion ist die stärkste Säure, die in wässriger Lösung existieren kann.)
HA + H₂O ⇌ A¹⁻ + H₃O⁺
c(H₃O⁺) = c₀(HA)
pH = - lg (c₀(HA))
Bsp.: Wie groß ist pH für Salzsäure mit 0,01 mol/L HCl?
Antw.: Ausgangskonz. = Konz. an c(H₃O⁺) = 0,01 mol/L = 10⁻² mol/L
pH = 2
Für starke Basen werden in wässrigen Lösungen vollständig protoniert.
c(OH⁻) = c₀(A¹⁻)
Bsp.: Wie groß ist der pH-Wert von Natronlauge mit 0,1 mol/L NaOH?
c(OH⁻) = 0,1 mol/L
pOH = - lg 10⁻¹ = 1
pH = 14 – pOH = 13
b) schwache Säuren und Basen
HA + H₂O ⇌ A¹⁻ + H₃O⁺
Das GG liegt fast vollständig auf der linken Seite (c₀ >> c(A¹⁻))
c(HA) = c₀(HA)

für Basen entsprechendes (Ersetzung mit c(OH⁻); pOH; pKB; A¹⁻
Bsp.:
1. Nenne die Oxoniumionen-Konzentration und den pH-Wert in einer Lösung von salpetriger Säure mit c₀(HNO₂) = 0,10 mol/L bei 25°C? (KS = 4,5 • 10⁻⁴ mol/L)
HNO₂ + H₂O ⇌ NO₂⁻ + H₃O⁺
![]()
2. Die Lösung einer schwachen Säure HX mit 0,10 mol hat den pH-Wert von 3,30. Wie groß ist der KS und der pKS-Wert?
geg.:

3. Welchen pH-Wert hat eine Lösung von 0,1 mol Natriumacetat pro Liter (pKS = 4,74) ? Formuliert dazu auch die Reaktionsgleichung als Strukturformeln.
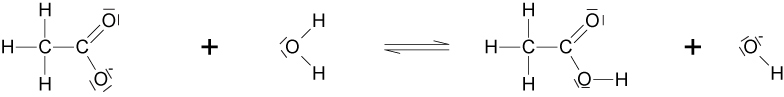
CH₃COO¹⁻ + H₂O ⇌ CH₃COOH + OH⁻
pKB = 14 – pKS =14 – 4,74 = 9,26
Schwache Base:
![]()
