Wiederholung: Oxidationszahl und Redoxreaktionen mit Molekülen
Oxidationszahl
Def.: Die Oxidationszahl gibt an, welche Ladung ein Atom in einem Molekül oder in einem anderen Teilchen hätte, wenn alle am Aufbau des Teilchens beteiligten Atome in Form von Ionen vorlägen.
Die sich für die Atome in der Verbindung ergebenden formalen Ladungszahlen nennt man Oxidationszahlen. Zur Unterscheidung von Ionenladungen werden sie als römische Zahlen an die Elementsymbole geschrieben.
Ermittlung der Oxidationszahl
- Schritt: Strukturformel erstellen.
- Schritt: Ermittlung der Elektronegativität aller Elemente.
- Schritt: Bindungselektronen werden formal dem elektronegativeren Bindungspartner zugeteilt. Besitzen die Bindungspartner die gleiche Elektronegativität erhalten sie je die Hälfte der Bindungselektronen.
- Schritt: Vergleicht man die Elektronenzahl eines Atoms, die man aus Schritt 3 erhält mit der Elektronenzahl im elementaren Zustand (= Hauptgruppennummer im PSE), so erhält man die Oxidationszahl.
Bsp.: Wasser
Oxidationszahl = Hauptgruppennummer – Elektronenzahl unter Berücksichtigung der EN
Oxidationszahl(O) = 6 - 8 = - 2 = - II
Oxidationszahl(H) = 1 - 0 = +1 = +I
5. Schritt: Kontrolle: Summe der Oxidationszahlen:
a) bei Molekülen = 0
b) bei Ionen = Ionenladungszahl
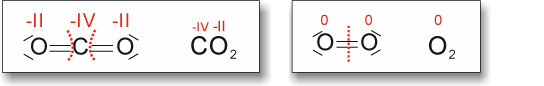
Hinweis: Die Oxidationszahl für C bei CO2 müsste natürlich +IV sein.
Faustregel:
Achtung, es gibt Faustregeln, die aber immer wieder zu Fehlern (häufig auch Leichtsinnsfehlern) verleiten. Deshalb rate ich von diesen Faustregeln ebenso ab wie vom Überschlagen im Kopf, sofern man eine Strukturformel erstellen und die Oxidationszahlen darüber bestimmen kann. Bei komplexeren, anorganischen Molekülen helfen dann die folgenden Faustformeln:
- Fluor immer: –I
- Wasserstoff: +I
- Sauerstoff: -II
- Halogene: -I (sofern nicht mit Sauerstoff oder einem elektronegativeren Halogen verbunden sind)
- Metalle meist positiv
Alkalimetalle +I
Erdalkalimetalle +II
Übungen:
Mit Hilfe der Oxidationszahl lassen sich die Begriffe Oxidation und Reduktion neu fassen:
Oxidation: (Elektronenabgabe) bedeutet eine Erhöhung der Oxidationszahl.
Reduktion: (Elektronenaufnahme) bedeutet eine Erniedrigung der Oxidationszahl.
Redoxreaktionen: sind Vorgänge bei denen sich die Oxidationszahlen der beteiligten Atomarten ändern.
a) Vollständige Verbrennung von Kohlenstoff
{slider title="Lösung" open="false" class="icon"}
Hinweis: Die Oxidationszahl für C bei CO2 müsste natürlich +IV sein. ![]()
Kohlenstoff Sauerstoff Kohlenstoff(IV)-dioxid
Kohlenstoff wird oxidiert, Sauerstoff wird reduziert.
{/sliders}
b) Reaktion von Wasserstoff mit Sauerstoff
{slider title="Lösung" open="false" class="icon"}
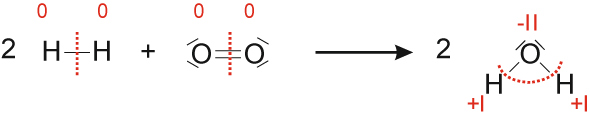
Wasserstoff Sauerstoff Wasser
{/sliders}
Aufgaben
a) Formuliere die Reaktion von Wasserstoff mit Stickstoff zu Ammoniak (NH₃)
{slider title="Lösung" open="false" class="icon"}
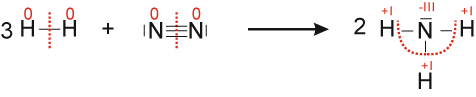
3 H₂ + N₂ → 2 NH₃ ΔH < 0
{/sliders}
b) Formuliere die Reaktion von Schwefel mit Sauerstoff zu Schwefeldioxid (SO₂) ⇨ ohne Lewis- bzw. Strukturformeln; dafür mit Faustformeln (vgl. oben):
{slider title="Lösung" open="false" class="icon"}
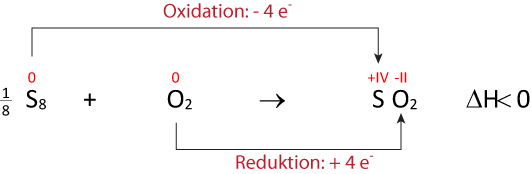
{/sliders}
