5.1.7 Isoelektrischer Punkt
Leitfähigkeitstitration = Konduktometrie
Problem: Wie verhalten sich die drei Glycin-Lösungen mit unterschiedlichen pH-Wert beim Leitfähigkeitsversuch?
Versuch: Leitfähigkeitsmessungen mit folgenden drei Lösungen:
- 40 mL Glycin-Lösungen (c = 0,1 mol/L) + 20 mL Salzsäure (c = 1 mol/L)
- 40 mL Glycin-Lösungen (c = 0,1 mol/L) + 20 mL Natronlauge (c = 1 mol/L)
- 60 mL Glycin-Lösung (c = 0,1 mol/L)
Ergebnis: Von den 3 untersuchten Glycin-Lösungen leiten die alkalische und saure Lösung den elektrischen Strom. Die wässrige Glycin-Lösung (pH-Wert ca. 6,0) zeigt (fast) keine Leitfähigkeit.
Isoelektrischer Punkt: Der pH-Wert bei dem eine Aminosäure ihre minimalste elektrische Leitfähigkeit zeigt, ist der isoelektrische Punkt (IEP). Die Konzentration an Zwitterionen hat hier ein Maximum erreicht.
Leitfähigkeit der verschiedenen Ionen:
| Ionensorte | Leitfähigkeit bei 25°C in S∙cm²/mol |
| H₃O⁺ (aq) | 350 |
| OH⁻ (aq) | 198 |
| Na⁺ (aq) | 50 |
| Cl⁻ (aq) | 76 |
Bsp.: Titration einer Salzsäure mit Natronlauge
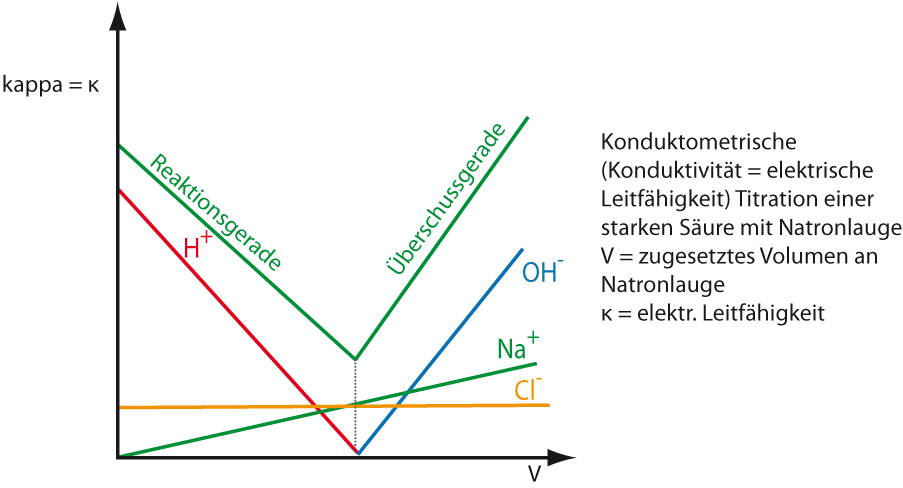
Die Leitfähigkeit Κ setzt sich additiv aus den Einzelleitfähigkeiten aller vorhandenen Ionen zusammen. Bei Oxonium- und Hydroxid-Ionen „klappen dabei H-Brücken um“.
Dissoziation der gelösten Stoffe, die im elektrischen Feld
wandern, abhängig von:
- Anzahl der Ionen (Konzentration)
- Anzahl der Elementarteilchen pro Ion
- Wanderungsgeschwindigkeit ( Natur der Ionen, Größe der Solvathülle, Viskosität des Lösungsmittels, Feldstärke)
- Polarität des Lösungsmittels
- Temperatur
Den Äquivalenzpunkt findet man durch Extrapolation (niedrigster Leitfähigkeitswert)

