4 Atombindung = Elektronenpaarbindung
{slider title="Link zur interaktiven Übungsseite mit Bildern" open="false" class="icon"}
Hier empfehle ich auf jeden Fall die Übungsseite!
{/sliders}
Beispiel 1: Bildung eines Wasserstoffmolekül (H₂)
Nähern sich zwei Wasserstoffatome (H•), so können sich die beiden „Kugelwolken“ (Orbitale) in einem gewissen Ausmaß durchdringen („überlappen“). Es bildet sich eine neue Molekülorbital, die beide Atomkerne umschließt.

Zwischen den beiden Kernen kommt es zu einer Verdichtung der negativen Ladung, zu der beide Elektronen gleichviel beitragen und die zur Anziehung zwischen den beiden positiv geladenen Kernen führt. Die beiden Elektronen bezeichnet man als bindendes Elektronenpaar. Beide Atome nutzen das Elektronenpaar gemeinsam.
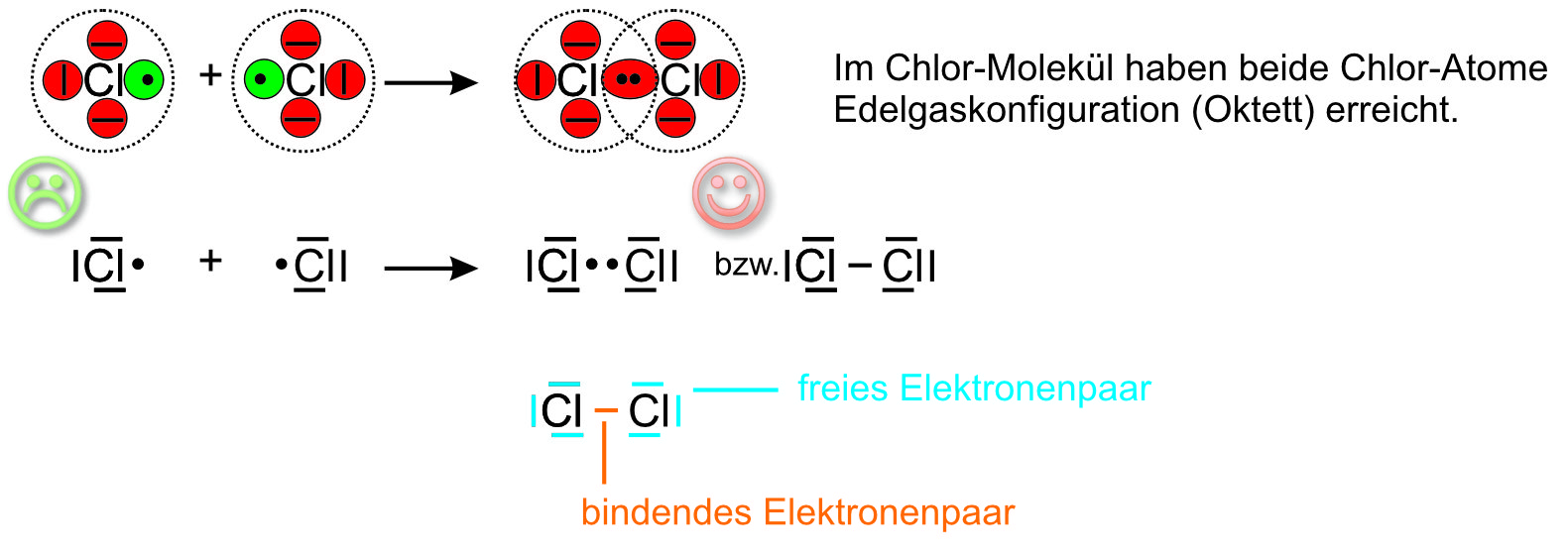
Beispiel 2: Bildung eines Chlor-Moleküls, Cl₂-Molekül
Versucht nun einmal selbständig die Abbildungen vom Wasserstoff oben auf das Beispiel Chlor zu übertragen. Kommt ihr nicht weiter oder seid ihr fertig, macht die Lösung auf.
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Bindigkeit: Zahl der von einem Atom gebildeten Atombindung.
Im Chlormolekül ist Chlor einbindig; beide Chlor-Atome gelangen durch das gemeinsame (bindende) Elektronenpaar in den Besitz von 8 Außenelektronen (Oktett, Edelgaskonfiguration).
Beispiel 3: Bildung eines Stickstoffmoleküls, N₂-Moleküls
Jetzt solltet ihr einmal die Bildung eines Stickstoffmoleküls zeichnen (einmal noch nach den Kugelwolkenmodell und einmal in Lewis-Formel):
{slider title="Lösung" open="false" class="icon"}
{/sliders}