1.3 Neue Definitionen
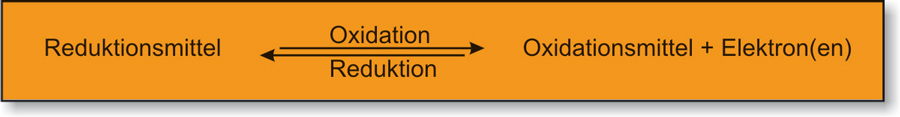
Oxidation = Elektronenabgabe
Reduktion = Elektronenaufnahme
Redoxreaktionen: Reaktionen mit Elektronenübertragung.
Oxidation und Reduktion laufen gleichzeitig ab.
Oxidationsmittel: Elektronenakzeptor („Elektronenräuber“)
Reduktionsmittel: Elektronendonator („ Elektronenspender“) [ nicht freiwillig ]
Merke: Ein Oxidationsmittel oxidiert ein anderes Teilchen und wird dabei selber reduziert.
Ein Reduktionsmittel gibt Elektronen ab, die es später wieder aufnehmen kann. Es wird also zu einem Oxidationsmittel.
Redoxpaar: z.B.
![]()
Jede Redoxreaktion man formal in zwei Teilreaktionen zerlegen:
(1) Oxidation (Elektronenabgabe)
(2) Reduktion (Elektronenaufnahme).
Beispiel: Lithium reagiert mit Chlor
(1) Oxidation: Li → Li⁺ + 1 e⁻ | · 2
(2) Reduktion: Cl₂ + 2 e⁻ → 2 Cl⁻ | · 1
______________________________________________________
Teilchengleichung: 2 Li + Cl₂ → 2 Li⁺ + 2 Cl⁻
Reaktionsgleichung: 2 Li(s) + Cl₂ (g) → 2 LiCl(s) ΔH < 0
Achtung:
Die Zahl der abgegebenen und aufgenommenen Elektronen muss gleich sein; die Elektronenbilanz muss stimmen (gemeinsames Vielfaches!).
Aus diesem Grund muss man das Teilschema (1) mit dem Faktor 2 multiplizieren
Die Formel für das Salz LiCl besagt, dass im festen LiCl, die Lithium-Ionen und die Chlorid-Ionen im Stoffmengenverhältnis
n(Li⁺) : n(Cl-) = 1 : 1 vorhanden sind.
Aufgaben:
Formuliere für folgende Reaktionen
- die Teilreaktionen.
- Stelle abschließend jeweils die Teilchengleichung und die
- Reaktionsgleichung auf.
- Achte darauf, welche Elemente molekular vorkommen und formuliere die Molekülformel auch in den Teilreaktionen.
a) Magnesium + Chlor
b) Aluminium + Sauerstoff
a) Magnesium + Chlor
{slider title="Lösung" open="false" class="icon"}
(1) Oxidation: Mg → Mg²⁺ + 2 e⁻ | · 1
(2) Reduktion: Cl₂ + 2 e⁻ → 2 Cl⁻ | · 1
-----------------------------------------------------------------------------------------
Teilchengleichung: Mg + Cl₂ → Mg²⁺ + 2 Cl⁻
Reaktionsgleichung: Mg + Cl₂ → MgCl₂
Die Formel für das Salz MgCl₂ besagt, dass im festen Magnesiumchlorid, die Magnesium-Ionen und die Chlorid-Ionen im Stoffmengenverhältnis n(Mg²⁺) : n(Cl-) = 1 : 2 vorhanden sind.
{/sliders}
b) Aluminium + Sauerstoff
{slider title="Lösung" open="false" class="icon"}
(1) Oxidation: Al → Al³⁺ + 3 e⁻ | · 4
(2) Reduktion: O₂ + 4 e⁻ → 2O²⁻ | · 3
---------------------------------------------------------------------------------
Teilchengleichung: 4 Al + 3 O₂ → 4 Al³⁺ + 6 O²⁻
Reaktionsgleichung: 4 Al + 3 O₂ → 2 Al₂O₃
Das Ionengitter des Aluminiumoxids ist elektrisch neutral, wenn auf zwei Aluminium-Ionen (Al³⁺) drei Oxid-Ionen (O²⁻) entfallen. Das Anzahlverhältnis muss 2 : 3 lauten: (Al³⁺)₂(O²⁻)₃ oder Al₂O₃ (Verhältnisformel).
{/sliders}
Verhältnisformeln der Salze geben das Zahlenverhältnis der Ionen im Ionengitter an!