Elektrochemie
1 Freiwillig ablaufende Redoxreaktionen
1.1 Wiederholung bekannter Begriffe und Definitionen
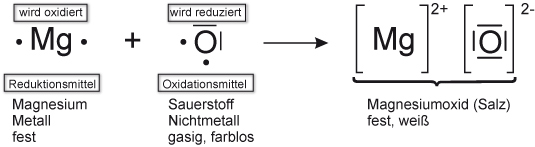
Versuch 1: Magnesium + Sauerstoff
Magnesium verbrennt mit stark leuchtender Flamme. Ein weißer Feststoff bleibt übrig.
Formuliere die Reaktionsgleichungen und ein Redoxschema:
{slider title="Lösung" open="false" class="icon"}
Zunächst vereinfacht atomar (Natürlich liegt Sauerstoff molekular vor):
Vollständiger:
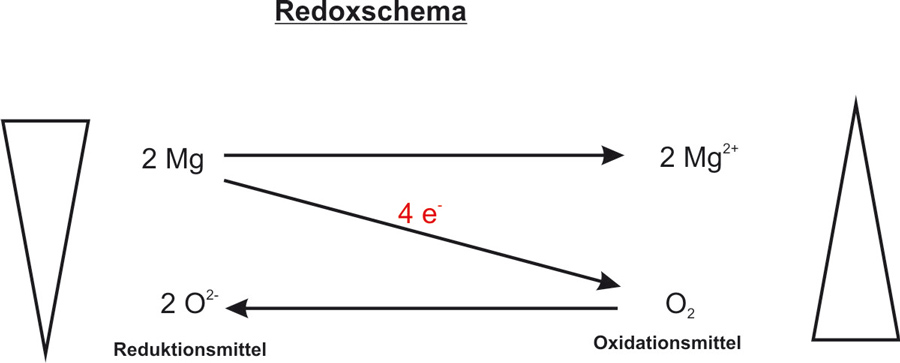
Reaktionsgleichung: 2 Mg + O2 → 2 MgO ΔH < 0
Redoxschema:
{/sliders}
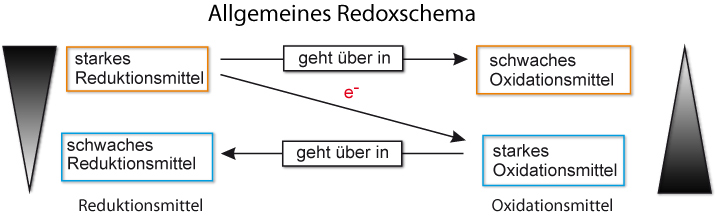
Einfach ist es, wenn man die Teilreaktionen (Oxidation und Reduktion) erstellt und dann erst die Redoxreaktion. Versucht mal diese zu formulieren:
{slider title="Lösung" open="false" class="icon"}
Oxidation: Mg → Mg²+ + 2 e- | • 2
Reduktion: O2 + 4 e- → 2 O2- | • 1
-----------------------------------------------------
Redoxreaktion: 2 Mg + O2 → 2 Mg2+ + 2 O2-
{/sliders}
Begriffe und Definitionen
Oxidation = Elektronenabgabe; Erhöhung der Oxidationszahlen
Reduktion = Elektronenaufnahme; Erniedrigung der Oxidationszahlen
Oxidationsmittel: Elektronenakzeptor, („Elektronenräuber“); wird bei der Reaktion selbst reduziert. [Eselsbrücke: Putzmittel]
Reduktionsmittel: Elektronendonator („ Elektronenspender“) [ nicht freiwillig ]; wird bei der Reaktion selbst oxidiert.
Redoxreaktionen: Reaktionen mit Elektronenübertragung.
Oxidation und Reduktion laufen gleichzeitig ab.
Ein Reduktionsmittel gibt Elektronen ab, die es später wieder aufnehmen kann. Es wird also zu einem Oxidationsmittel.

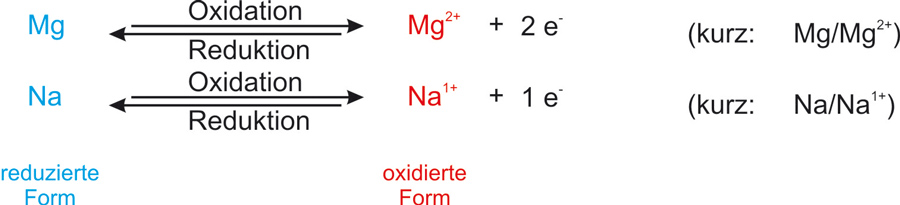
Reduktionsmittel und Oxidationsmittel bilden ein korrespondierendes Redoxpaar:
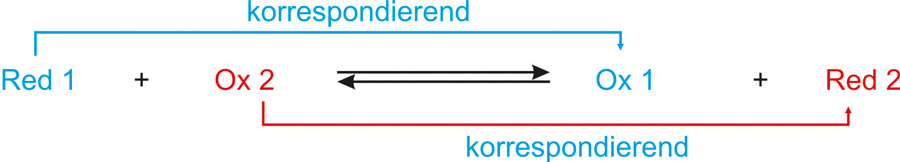
Die übliche Kurzschreibweise für ein Redoxpaar:
Reduzierte Form/oxidierte Form
Me/Men+
Bei jeder Redoxreaktion sind zwei korrespondierende Redoxpaare beteiligt (analog: Protolysereaktion)
Achtung:
Die Zahl der abgegebenen und aufgenommenen Elektronen muss gleich sein; die Elektronenbilanz muss stimmen (gemeinsames Vielfaches!).