1.2 Erstellung einer Redoxreihe
Allgemein: Metallatome können als Reduktionsmittel, Metallkationen als Oxidationsmittel reagieren. Durch Kombination eines beliebigen Metalls mit den Kationen eines anderen Metalls (bzw. dessen Salz) kann daher die relative Stärke eines Oxidations- bzw. Reduktionsmittels bestimmt werden.
Problem: Welches Metall (Zink, Kupfer, Silber, Eisen) sind stärkere Reduktionsmittel.
Experiment: vgl. AB Redoxreaktionen – Elektronenübergangreaktionen
Beobachtung:
| Zn²⁺ | Cu²⁺ | Fe²⁺ | Ag¹⁺ | |
| Zn | x |
rotbrauner Feststoff |
Eisenniederschlag | Silberüberzug |
| Cu | nichts | x | nichts | Silberüberzug |
| Fe | nichts | rotbrauner Feststoff | x | Silberüberzug |
| Ag | nichts | nichts | nichts | x |
Auswertung:
Welche Teilchen liegen vor der Reaktion vor?
Cu + Zn²⁺ ⇨ keine Reaktion
Fe + Zn²⁺ ⇨ keine Reaktion
Cu + Fe²⁺ ⇨ keine Reaktion
Zn + Fe²⁺ ⇨ Eisenniederschlag
Zn + Cu²⁺ ⇨ rotbrauner Niederschlag
Fe + Cu²⁺ ⇨ rotbrauner Niederschlag
Ag + Zn²⁺ ⇨ keine Reaktion
Ag + Cu²⁺ ⇨ keine Reaktion
Ag + Fe²⁺ ⇨ keine Reaktion
Ag¹⁺ + Zn ⇨ Silberüberzug
Ag¹⁺ + Cu ⇨ Silberüberzug
Ag¹⁺ + Fe ⇨ Silberüberzug
Wie liegen die Teilchen in wässriger Lösung vor?
Als Ionen mit einer Hydrathülle; Schreibweise z.B. Zn²⁺ (aq)
Wie lassen sich die Beobachtungen erklären? Formuliert für stattfindende Reaktionen die
- Teilreaktionen,
- Teilchenreaktion,
- Reaktionsgleichung und
- unter Umständen dazugehörige Redoxschemata.
Reagenzglas 4: Zn-Elektrode in Eisen(II)-chloridlösung
{slider title="Lösung" open="false" class="icon"}
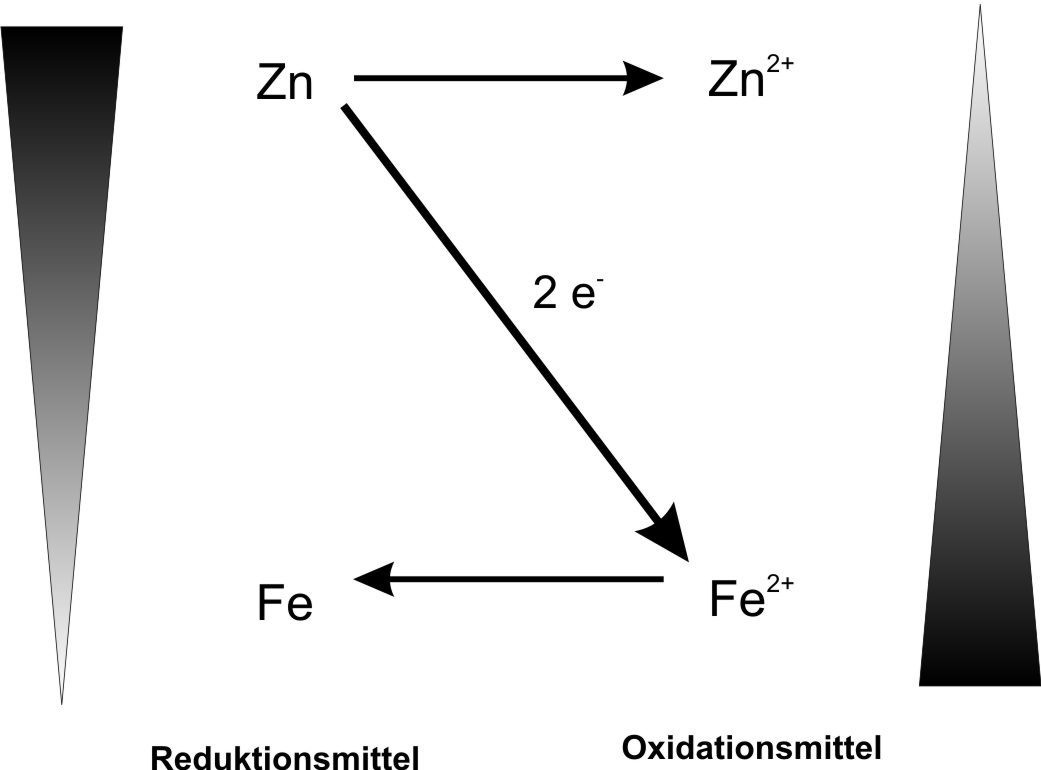
Oxidation: Zn → Zn²⁺ (aq) + 2 e⁻
Reduktion: Fe²⁺ (aq) + 2 e⁻ → Fe
----------------------------------------------------------------------------
Eigentliche Reaktion: Zn + Fe²⁺(aq) → Zn²⁺(aq) + Fe
Teilchengleichung: Zn + Fe²⁺(aq) + 2 Cl⁻ (aq) → Zn²⁺(aq) + 2 Cl⁻(aq) + Fe
Reaktionsgleichung: Zn + FeCl₂ → ZnCl₂ + Fe
Redoxschema:
{/sliders}
Reagenzglas 5: Eisennagel in Kupfer(II)-sulfatlösung
{slider title="Lösung" open="false" class="icon"}
Oxidation: Fe → Fe²⁺(aq) + 2 e⁻
Reduktion: Cu²⁺(aq) + 2 e⁻ → Cu
-----------------------------------------------------------------------
Eigentliche Reaktion: Fe + Cu²⁺(aq) → Fe²⁺(aq) + Cu
Teilchengleichung: Fe + Cu²(aq) + SO₄²⁻(aq) → Fe²⁺(aq) + SO₄²⁻ (aq) + Cu
Reaktionsgleichung: Fe + CuSO₄ → FeSO₄ + Cu
{/sliders}
Reagenzglas 6: Zinkelektrode in Kupfer(II)-sulfatlösung
{slider title="Lösung" open="false" class="icon"}
Oxidation: Zn → Zn²⁺(aq) + 2 e⁻
Reduktion: Cu²⁺(aq) + 2 e⁻ → Cu
--------------------------------------------------------------------
Eigentliche Reaktion: Zn + Cu²⁺(aq) → Zn²⁺(aq) + Cu
Teilchengleichung: Zn + Cu²⁺(aq) + SO₄²⁻(aq) → Zn²⁺(aq) + SO₄²⁻(aq) + Cu
Reaktionsgleichung: Zn + CuSO₄ → ZnSO₄ + Cu
{/sliders}
Reagenzglas 10,11,12: Zink/Eisen/Kupferelektrode in Silber(I)-nitratlösung
{slider title="Lösung" open="false" class="icon"}
RG 10: Oxidation: Zn → Zn²⁺(aq) + 2 e⁻
RG 11: Oxidation: Fe → Fe²⁺ (aq) + 2e⁻
RG 12: Oxidation: Cu → Cu²⁺ (aq) + 2 e⁻
RG 10-12 Reduktion: 2 Ag¹⁺(aq) + 2 e⁻ → 2 Ag
{/sliders}
Die Erklärung, warum und wie manche Reaktionen ablaufen findet man auch wieder in den Redox-Schemata; Überlegt euch, wie diese für die Reaktionen aussehen.
{slider title="Lösung" open="false" class="icon"}
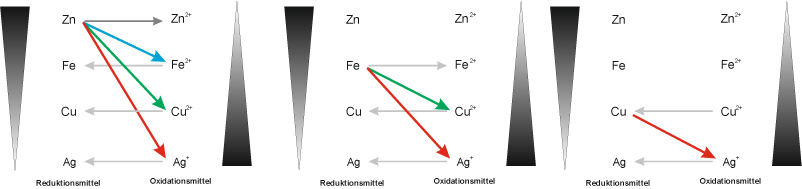
Redoxreihe: Das Zinkatom gibt am leichtesten Elektronen ab, das Silber am schwersten. Ordnet man Atome entsprechend ihrem Reduktionsvermögen, erhält man eine Reihe, in der oben (links) unedle und unten (rechts) Edelmetalle stehen.
Das Oxidationsvermögen nimmt von oben nach unten zu.
{/sliders}
Zusammenfassung: Redoxreaktionen laufen bevorzugt (freiwillig) so ab, dass das stärkere Reduktionsmittel mit dem stärkeren Oxidationsmittel zum schwächeren Reduktionsmitten und zum schwächeren Oxidationsmittel reagiert.