5.0.1 Elektroneutralität
Ältere Übungsseite
Elektroneutralität: Stoffe, die aus Ionen aufgebaut sind, sind elektrisch neutral, das heißt es müssen gleich viel positive wie negative Ladungen.
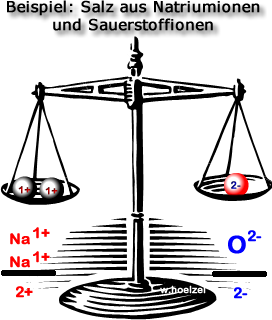
Beispiel: Betrachten wir ein Stoff der aus folgende Ionen aufgebaut ist: Na¹⁺ und O²⁻ .
Die Ladung dürfen wir nicht so einfach verändern, da die Edelgasregel erfüllt werden soll. O¹⁻ oder Na²⁺ sind somit falsch.
Wir können also nur die Anzahl der Ionen verändern. Dabei nimmt man das kleinste gemeinsame Vielfache.
Die Gesamtladung muss 0 ergeben. Folglich brauchen wir 2 Na¹⁺ und 1 O²⁻ um einen neutralen Stoff zu erhalten.
Lösung:
- Natriumoxid = 2 Na¹⁺ + 1 O²⁻
- Verhältnisformel = Na₂O₁ = Na₂O
Da Chemiker von Natur aus faul sind ( ;-) ), schreiben sie nie die 1.
Name: Natriumoxid (Dinatriumoxid, Natriummonooxid)
Ionenschreibweise: 2 Na¹⁺ + O²⁻
Aufgaben: Benenne entsprechend der Abbildung die (a) Ladung der Ionen, (b) Ionenschreibweise und (c) Verhältnisformel; Hast Du Schwierigkeiten bei dieser Aufgabe, dann befülle in Gedanken die Waage.
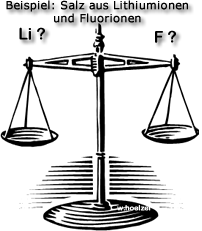
Aufgabe 1: Lithium-Ionen und Fluorid-Ionen
{slider title="Lösung" open="false" class="icon"}
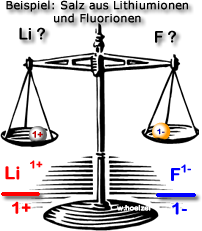
LiF
{/sliders}
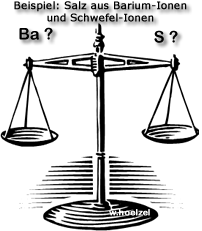
Aufgabe 2: Barium-Ionen und Schwefel-Ionen
Lösung
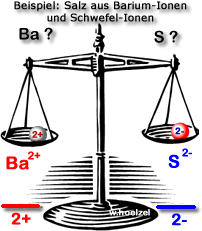
BaS
Aufgabe 3: Aluminium-Ionen und Sauerstoff-Ionen
{slider title="Lösung" open="false" class="icon"}
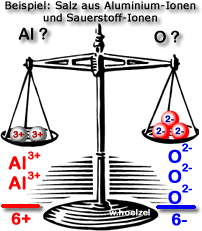
Al₂O₃
{/sliders}
Aufgabe 4: Magnesium-Ionen und Brom-Ionen
{slider title="Lösung" open="false" class="icon"}
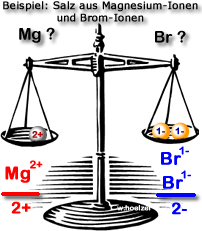
MgBr₂
{/sliders}