5.1.4 Versuch: Ethanol + Alkalimetall
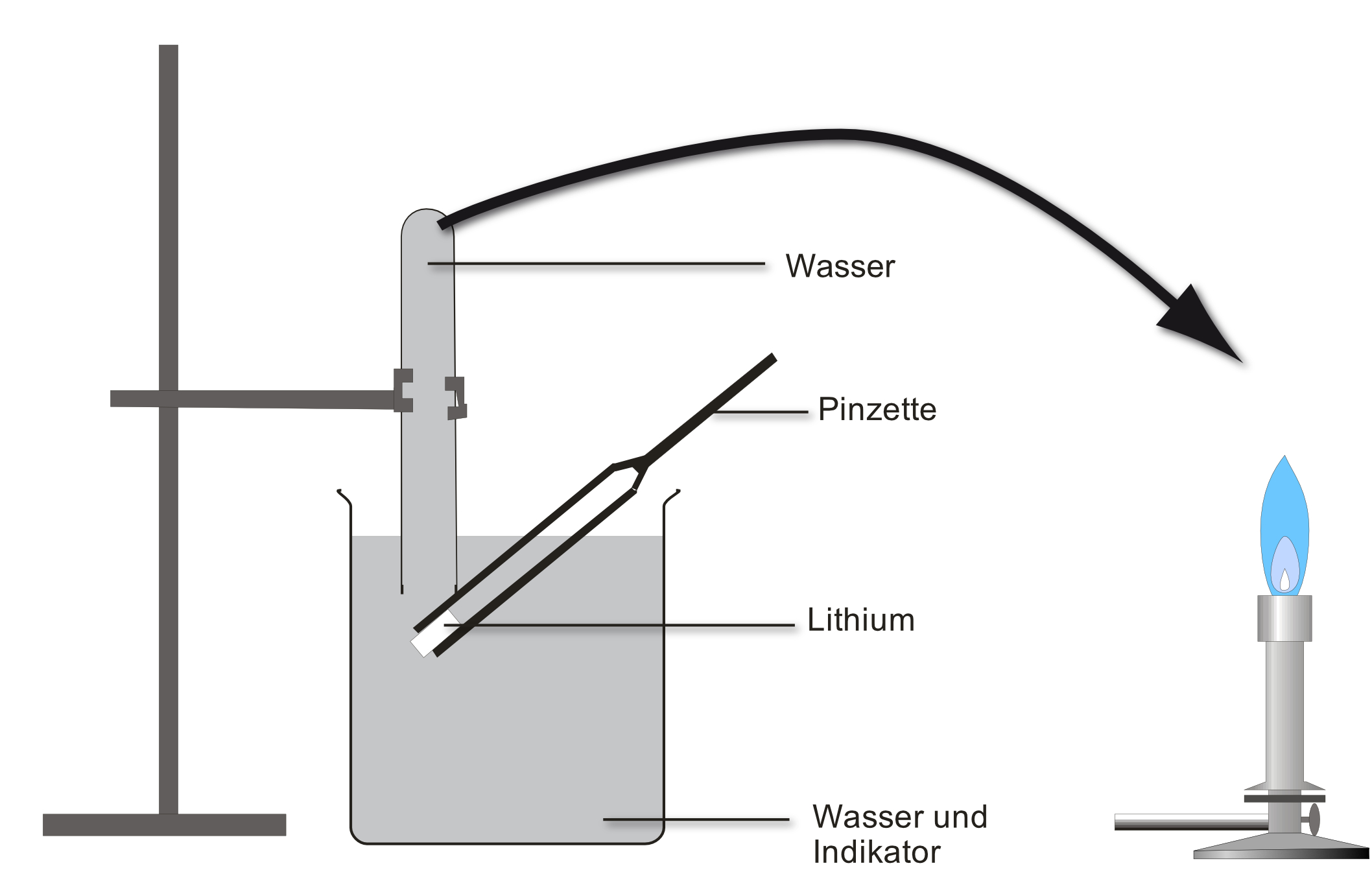
Versuch: Ein Stück Lithium ( SE ) wird auf Ethanol, Benzin und Wasser gegeben. Alternativ kann man die Experimente auch mit Natrium als Lehrerversuch durchführen. Die Reaktionsgleichungen sind mit dem Alkalimetall Natrium formuliert. Für Lithium gilt es analog.
Bei Wasser ist der Aufbau etwas komplizierter:
Beobachtung: Gasentwicklung; das entstehende Gas ist brennbar; Natrium „verschwindet“; die neu entstandene Lösung leitet den elektrischen Strom; dampft man die Lösung ein, entsteht ein weißer Feststoff.
Ergebnis:
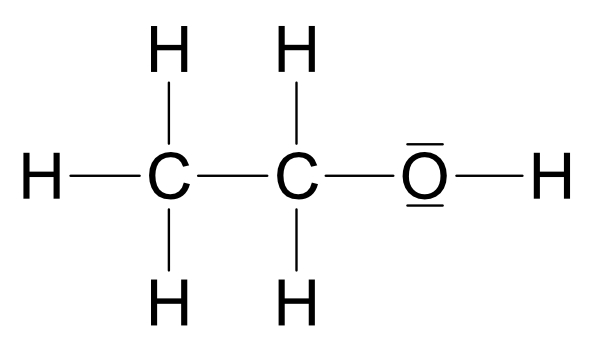
Ethanol (Struktur a) reagiert mit Natrium unter Wasserstoffbildung. Struktur b (Dimethylether) würde so nicht reagieren, da sich kein Proton abspalten kann. Somit besitzt Ethanol die Strukturformel:
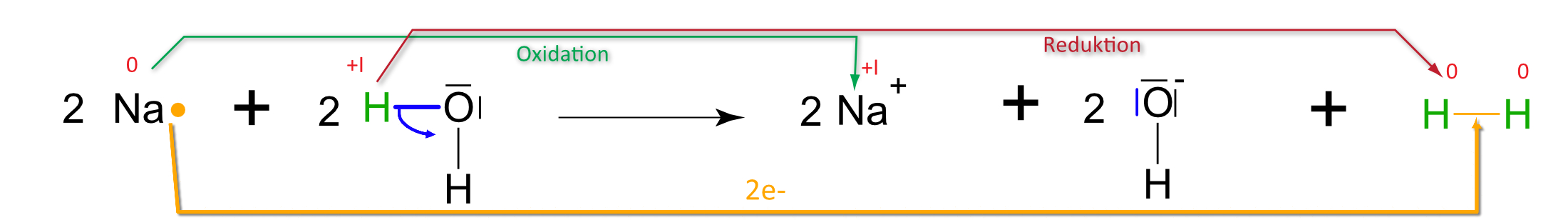
1. Natrium + Wasser
a) Teilchengleichung (mit Strukturformeln)
| 2 Na (s) | + | 2 H₂O (l) | → | 2 NaOH (aq) | + | H₂ (g) |
| Natrium | Wasser | Natriumhydroxid | Wasserstoff | |||
| fest | flüssig | gelöst | gasförmig |
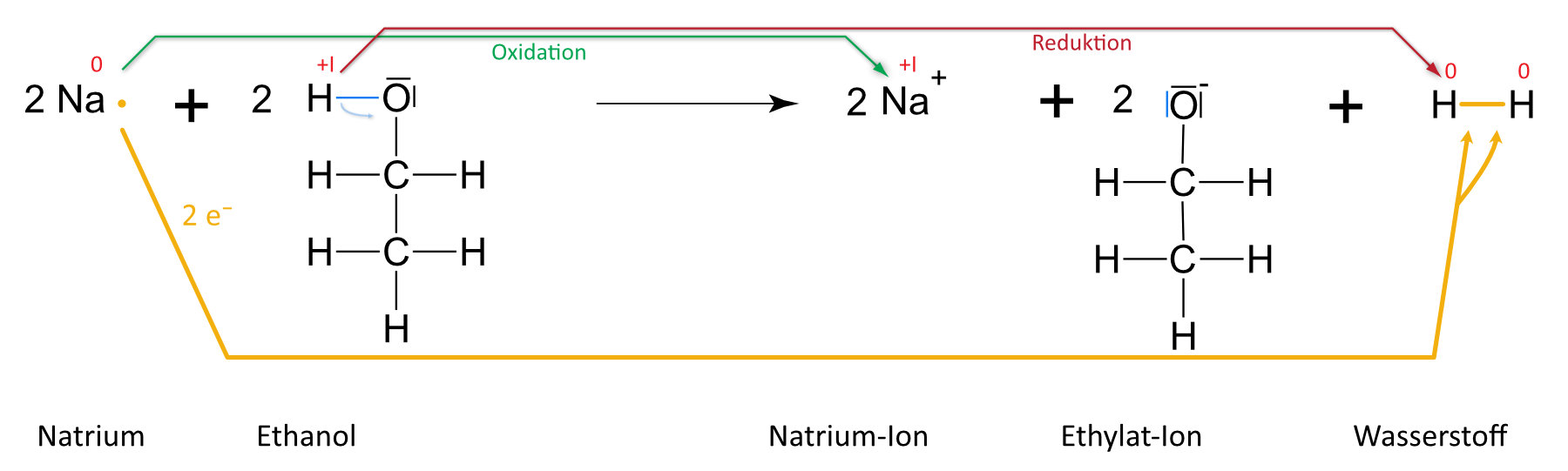
2. Natrium + Ethanol
Man kann Ethanol ja als Derivate (=Abkömmlinge) von Wasser betrachten. Wasser hat ein Sauerstoff-Atom und zwei Wasserstoff-Atome; Ethanol hat ein Sauerstoff-Atom, ein Wasserstoff-Atom und eine Ethyl-Gruppe. Beim Ethanol ist also ein Wasserstoff-Atom durch eine Ethylgruppe ersetzt. Wenn wir diese Alkylgruppe als "Rest" betrachten, dann zeigt sich die Verwandtschaft von Ethanol mit Wasser. Hat man also die Reaktionsgleichung von Wasser mit Natrium verstanden, dann müsste einem auch die Reaktionsgleichung von Ethanol (und anderen Alkoholen) leichtfallen. Versucht nun einmal, die Reaktion von Natrium mit Ethanol zu formulieren.
a) Teilchengleichung (mit Strukturformeln)
{slider title="Lösung" open="false" class="icon"}
{/sliders}
b) Reaktionsgleichung
{slider title="Lösung" open="false" class="icon"}
2 Na (s) + 2 C₂H₅OH (l) 2 NaC₂H₅O (aq) + H₂ (g)
{/sliders}
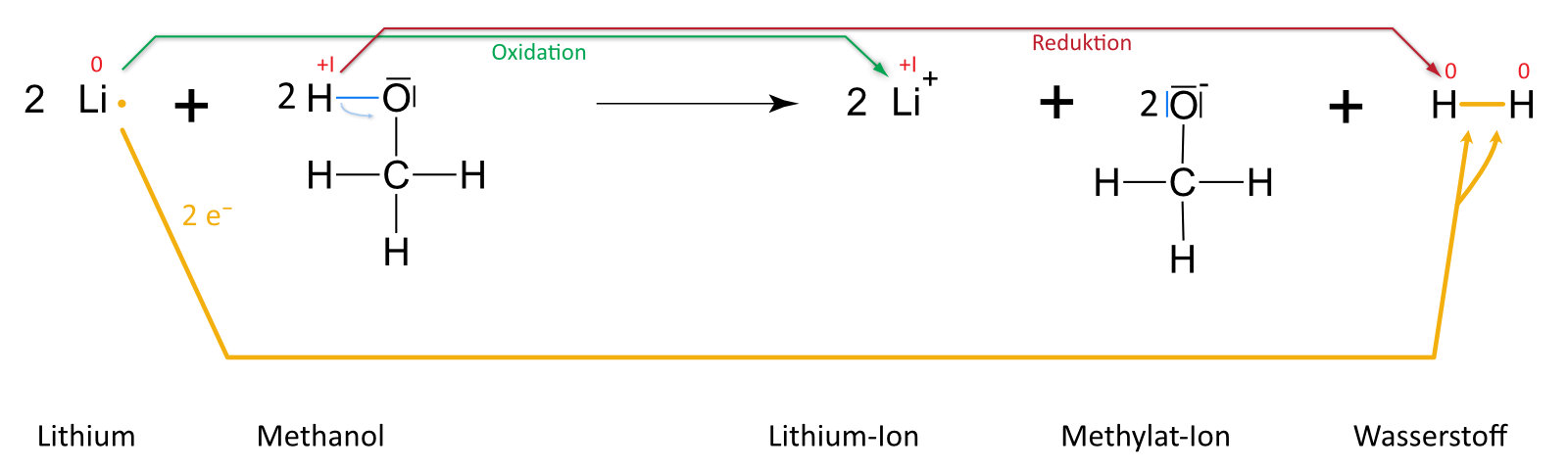
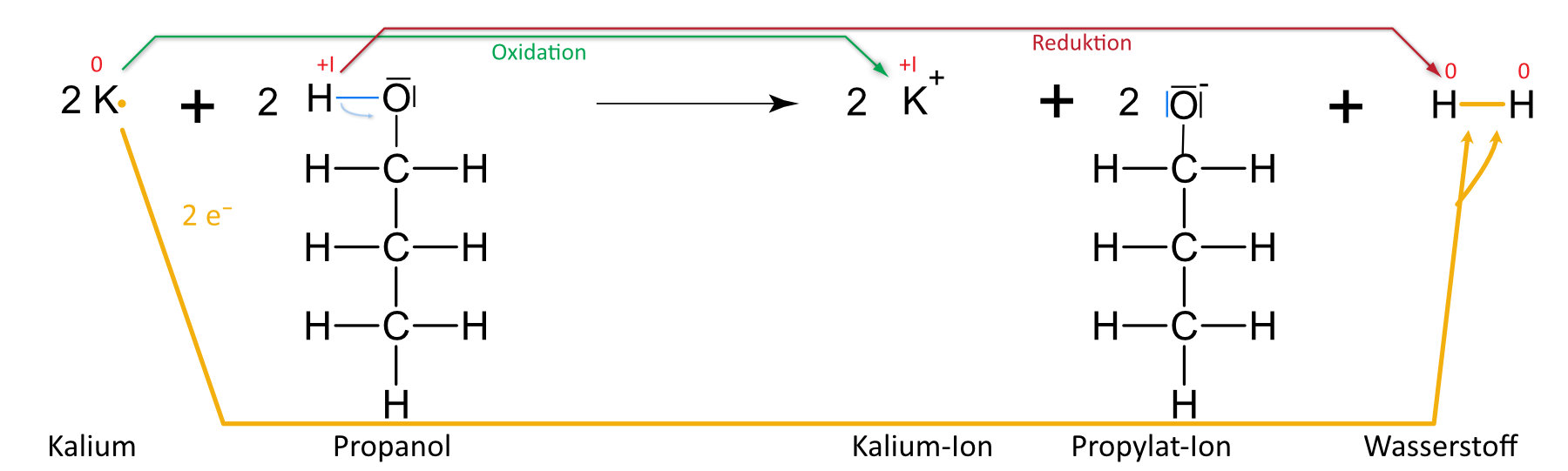
Auswertung: Es ist keine „klassische“ Säure-Base-Reaktion nach Brönstedt. Grund: +I-Effekt (vgl. unten) der Methylgruppe (Protonierung ist erschwert). Es handelt sich hier um eine Redoxreaktion (Veränderung der Oxidationenszahlen). Formal geben zwei Moleküle Ethanol je ein Proton ab. Jedes Proton nimmt von einem Natrium- bzw. Lithiumatom ein Elektron auf; es bilden sich so zwei Wasserstoffatome, die sich zu einem Wasserstoffmolekül zusammenlagern. Analog, nur heftiger, verläuft die Reaktion mit Wasser.
Weitere Übungen:
Lithium und Methanol
Formuliert auch dafür die Reaktionsgleichung (vgl. oben)
{slider title="Lösung" open="false" class="icon"}
{/sliders}
Kalium und Propanol
{slider title="Lösung" open="false" class="icon"}
{/sliders}