6 Chlorwasserstoff-Gas und Wasser (Springbrunnen)
Chlorwasserstoff: Summenformel HCl, polare Atombindung, Gas, stechender Geruch
Wasser: Summenformel H₂O, polare Atombindung, Flüssigkeit, geruchslos
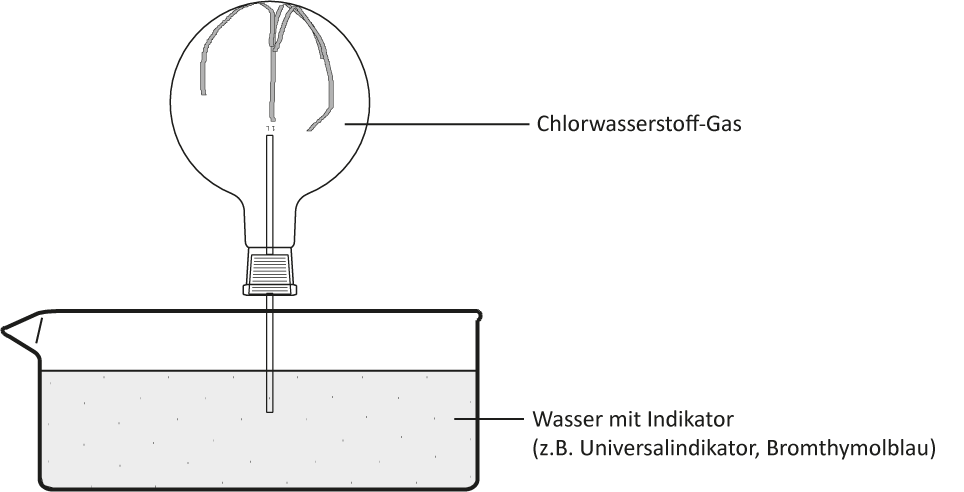
a) Versuch:
b) Beobachtung:
Das Wasser „schießt“ bergauf in den Rundkolben. Die Indikatorfarbe schlägt nach rot/gelb um. Die rote wässrige Lösung ist geruchlos.
c) Reaktionsgleichung – Struktur/Lewisformel:
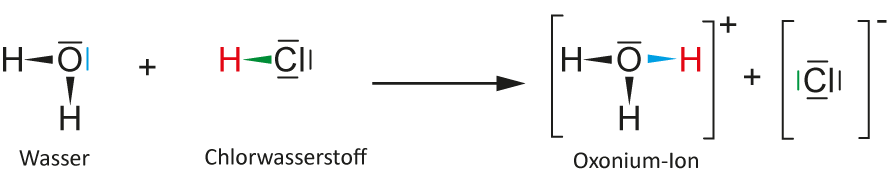
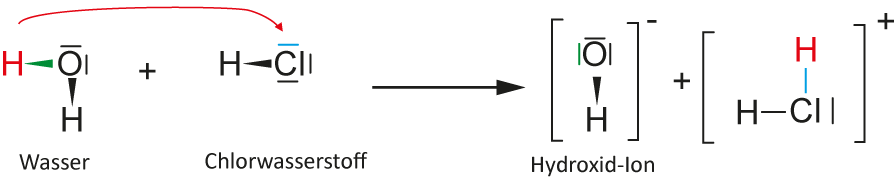
Theoretisch gibt es zwei Möglichkeiten, wie Wasser und Chlorwasserstoff reagieren können.
- Formuliere einmal diese zwei Möglichkeiten als Reaktionsgleichung mit Strukturformeln.
- Entscheide, welche dieser beiden möglichen Reaktionen tatsächlich abläuft. Falls du nicht drauf kommst, gehe zurück zum Thema: Säure-Stärke
{slider title="Lösung" open="false" class="icon"}
1. Möglichkeit:
2. Möglichkeit:
Chlorwasserstoff ist die stärkere Säure, da Chlor ein größeres Atom ist, als Wasserstoff. Außerdem ist das Hydroxid-Ion ist eine sehr starke Base.
{/sliders}
Nachweis der gebildeten Ionen:
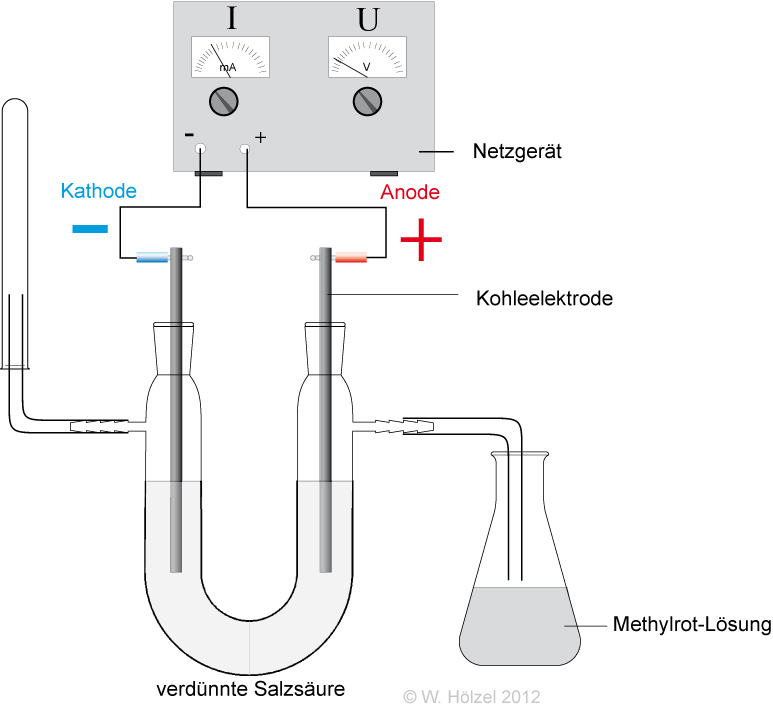
- Leitfähigkeitsmessung
- durch Elektrolyse: An der Anode (+-Pol) entsteht dabei Cl₂-Gas. Somit müssen in der verdünnten Salzsäure Chlorid-Ionen (Cl⁻-Ionen) vorliegen.
- durch Indikator: Die Gelbfärbung bei Bromthymolblau zeigt Oxonium-Ionen (H₃O⁺) an.
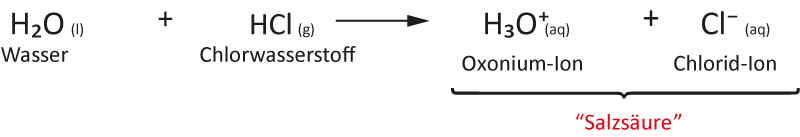
Reaktionsgleichung Zusammenfassung
{slider title="Lösung" open="false" class="icon"}
Begründung:
Chlor (vom Chlorwasserstoff) ist ein größeres Atom als Sauerstoff (vom Wasser). Deshalb ist Chlorwasserstoff eine stärkere Säure und gibt das Proton (H⁺) und Wasser nimmt das Proton auf.
verdünnte Salzsäure enthält hydratisierte Oxonium- und Chlorid-Ionen und Wassermoleküle.
{/sliders}
Verdünnte Salzsäure enthält hydratisierte Oxonium- und Chlorid-Ionen und Wassermoleküle.
d) Protolyseschema
Formuliere für diese Reaktion einmal das Protolyseschema:
{slider title="Lösung" open="false" class="icon"}
{/sliders}
e) Erklärung:
Chlorwasserstoff-Gas reagiert mit Wasser. Im Zylinder entsteht ein Unterdruck. Die Oxonium-Ionen färben den Universalindikator/Bromthymolblau rot/gelb.
| Salzsäure: = wässrige Lösung des Gases Chlorwasserstoff |
Wenn man sehr viel HCl-Gas in Wasser einleitet, reagieren nicht mehr alle HCl-Moleküle mit den H₂O-Molekülen. Diese HCl-Moleküle liegen „gelöst“ vor. Es ist so „rauchende“ bzw. konzentrierte Salzsäure entstanden.
| Leitfähigkeit | Geruch | Indikatorpapier | Teilchen | |
| verdünnte Salzsäure | + | - | rot | H₂O, H₃O⁺, Cl⁻ |
| rauchende Salzsäure | + | + | rot | H₂O, H₃O⁺, Cl⁻, HCl |