2 Der pH-Wert
Um das Ionenprodukt übersichtlicher beschreiben zu können, führt man den pH-Wert (potentia hydrogenii), den pOH-Wert und den pKW-Wert ein.
Der pH-Wert ist der negative dekadische Logarithmus der Oxonium-Ionenkonzentration.
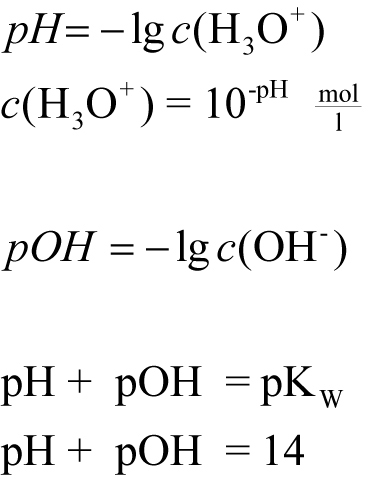
Folgende Werte gelten bei 25°C.
| c(H₃O⁺) | 10⁰ | 10⁻⁶ | 10⁻⁷ | 10⁻⁸ | 10⁻¹⁴ | mol/l |
| c(OH⁻) | 10⁻¹⁴ | 10⁻⁸ | 10⁻⁷ | 10⁻⁶ | 10⁰ | mol/l |
| pH | 0 | 6 | 7 | 8 | 14 | |
| pOH | 14 | 8 | 7 | 6 | 0 |
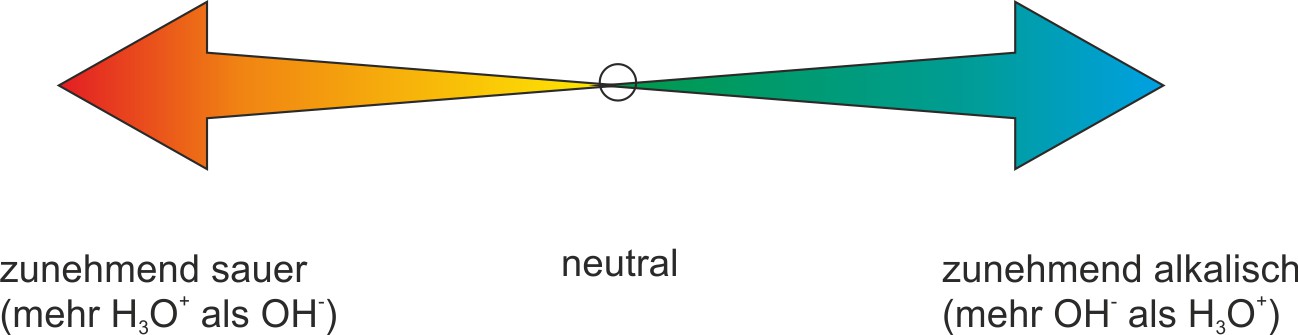
Zur Kennzeichnung, ob es sich um eine saure, neutrale oder alkalische Lösung handelt, reicht es vollständig aus, nur die Konzentration einer Ionensorte anzugeben (i.d.R. die Oxonium-Ionen-Konzentration).
Beispiel:
Aussage:
„pH = 2“: c(H₃O⁺) = 10⁻² mol/l = 0,01 mol/l
“pH = 12”: c(H₃O⁺) = 10⁻¹² mol/l = 0,000 000 000 001 mol/l
In einer sauren Lösung ist die c(H₃O⁺) > 10⁻⁷ mol/l ⇨ pH < 7
In einer alkalischen Lösung ist die c(OH⁻) > 10⁻⁷ mol/l ⇨ pH > 7
