1.4 Weitere (komplexere) Redoxreaktionen
Die Redoxreaktionen sind nicht immer ganz so einfach. Hier zunächst ein Beispiel:
Aufgabe: Schaut, welche Redox-Paare in eurer Tabelle (siehe Moodle) vorhanden sind.
Beispiel 1: Reaktion von Kaliumdichromat mit Eisen(II)-Sulfat
Teilchen: Kaliumdichromat: 2 K¹⁺ Cr₂O₇²⁻
Eisen(II)-sulfat: Fe²⁺ SO₄²⁻
Oxidation: Fe²⁺ → Fe³⁺ + e⁻ | x 6
Reduktion: Cr₂O₇²⁻ + 14 H₃O⁺ + 6 e⁻ → 2 Cr³⁺ + 21 H₂O
Redox: Cr₂O₇²⁻ + 14 H₃O⁺ + 6 Fe²⁺ → Fe³⁺ + 2 Cr³⁺ + 21 H₂O
Rktgl: 6 FeSO₄ (aq) + K₂Cr₂O₇ (aq) + 7 H₂SO₄ (aq) → 3 Fe₂(SO₄)₃ (aq) + Cr₂(SO₄)₃ (aq) + K₂SO₄ (aq) + 7 H₂O (l)
Beispiel 2: „Cl-Gas kann im Labor gewonnen werden, indem man Kaliumdichromat mit Salzsäure reagieren lässt. Der Ansatz für die Reaktionsgleichung lautet:
__ Cr₂O₇²⁻ + __H₃O⁺ + __ Cl⁻ → ___Cr³⁺ + __Cl₂ + __ H₂O
Richten Sie die Redoxgleichung ein. Formulieren Sie dazu die Teilgleichungen mit Oxidationszahlen.
{slider title="Lösung" open="false" class="icon"}
Oxidation: 2 Cl⁻ → Cl₂ + 2 e⁻ | x 3
Reduktion: Cr₂O₇²⁻ + 14 H₃O⁺ + 6 e⁻ → 2 Cr³⁺ + 21 H₂O
Redox: Cr₂O₇²⁻ + 14 H₃O⁺ + 6 Cl⁻ → 3 Cl₂ + 2 Cr³⁺ + 21 H₂O
{/sliders}
Aufgabe 1: Geben Sie in den nachfolgenden Formeln die Oxidationszahlen aller Atome an:
(vgl. Tafelanschrieb)
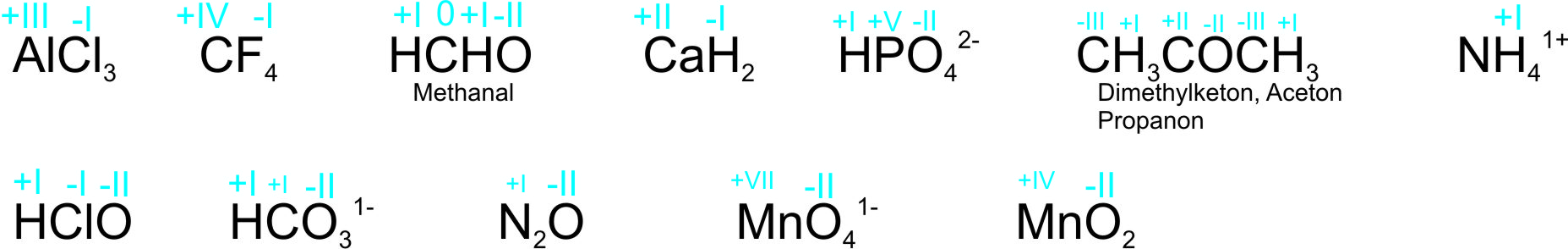
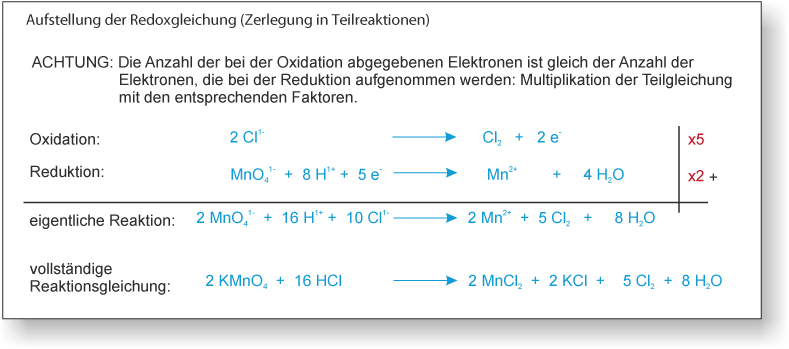
Aufgabe 2: Auf konzentrierte Kaliumpermangantlösung (KMnO₄) lässt man konzentrierte Salzsäure (HCl) einwirken. Bei dieser Reaktion entsteht u.a. Chlorgas und Mangan(II)-chlorid.
Vervollständigen Sie die folgenden Gleichungen für die obige Redoxreaktion (Vereinfacht wird statt H₃O⁺ H⁺ formuliert).
{slider title="Tipp" open="false" class="icon"}
__ Cl⁻ + __ MnO₄¹⁻ + __ H⁺ → __ Cl₂ + __ Mn²⁺ + __ H₂O
{/sliders}
{slider title="Lösung" open="false" class="icon"}
{/sliders}