Chemisches Gleichgewicht
1 Umkehrbare Reaktionen
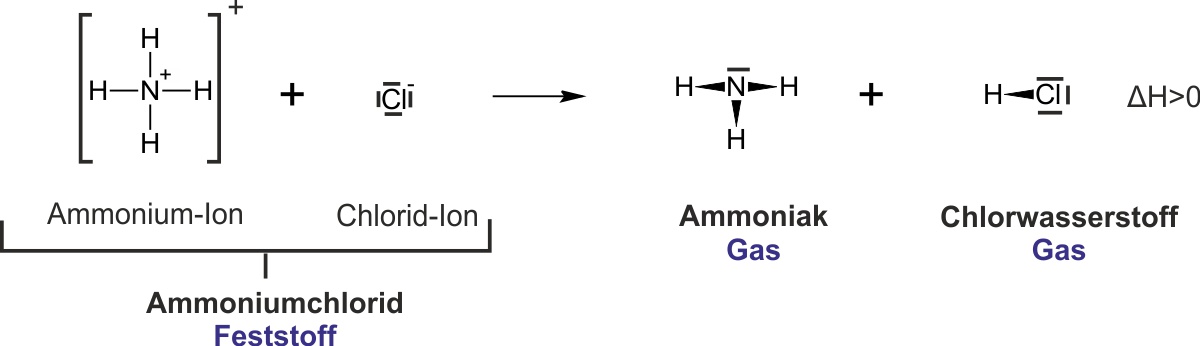
1.1 Beispiel: Ammoniumchlorid
a) Bildung von Ammoniumchlorid (vgl. Versuchsskizze - Heftaufschrieb)
Über ein geöffnetes Schnappdeckelglas stellt man ein umgekehrtes Becherglas, in welchem sich konzentrierte Salzsäure befindet.
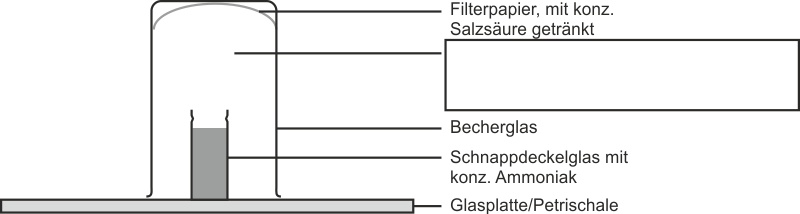
Beobachtung:
In dem Raum wischen Schnappdeckelglas und Filterpapier bildet sich ein weißer Rauch. Auf der Glasplatte bildet sich eine Schicht mit einem kristallinen weißen Feststoff.
Auswertung:

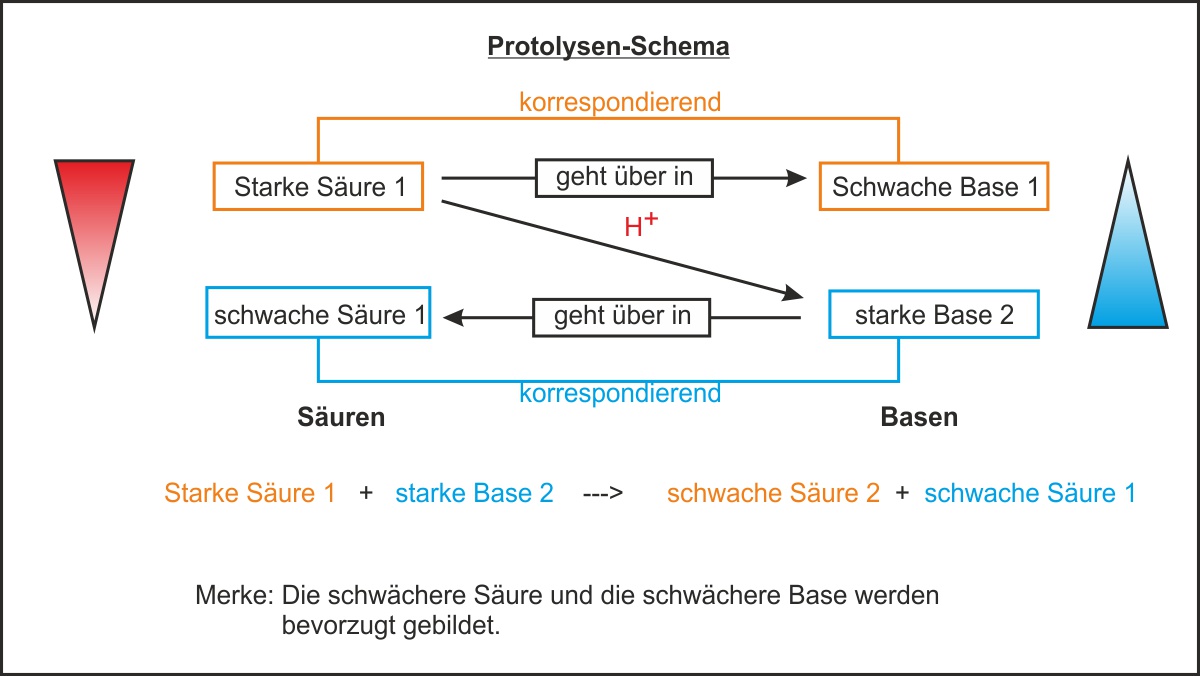
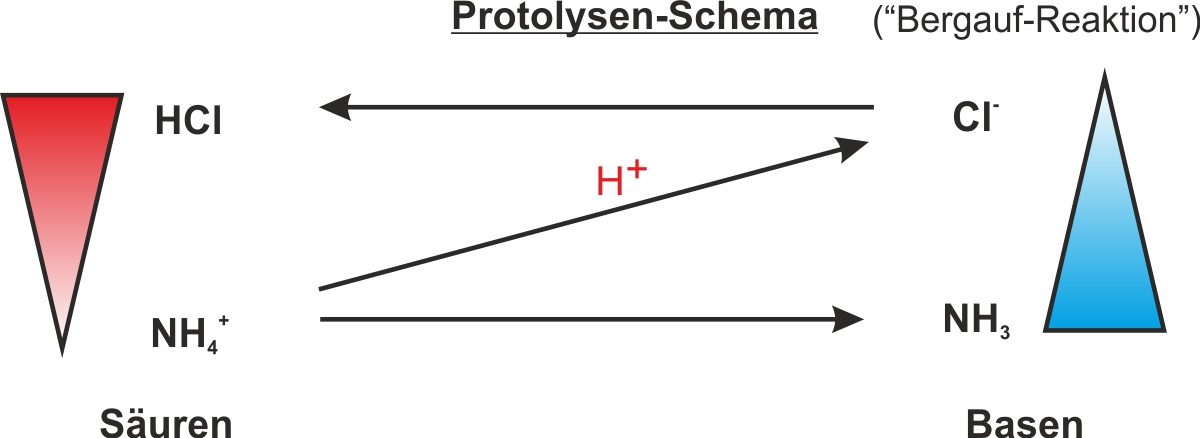
In der obigen Abbildung sind Fehler drin:
Richtig ist: Starke Säure 1 + starke Base 2 --> schwache Base 1 + schwache Säure 2
(Dank an Fiona Ulrich für die Korrektur).
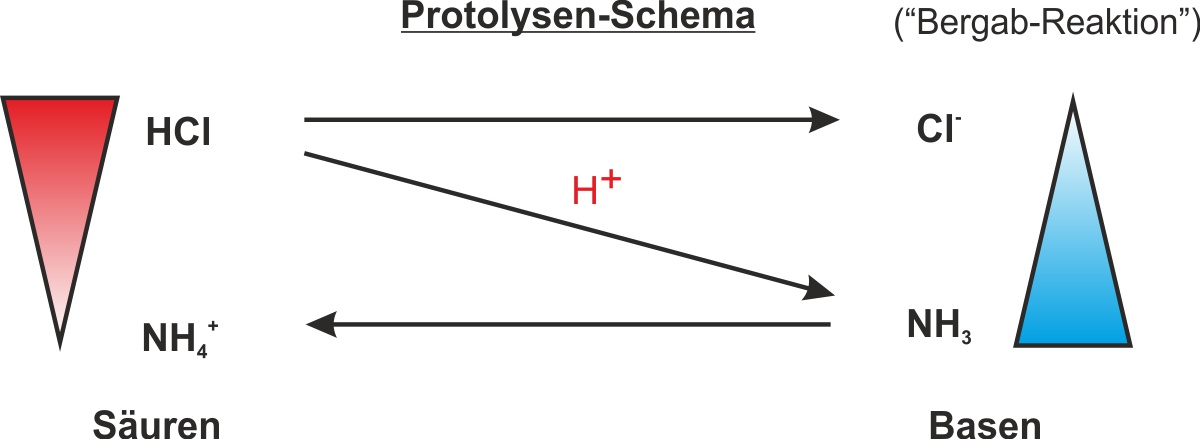
b) Zerlegung von Ammoniumchlorid (vgl. Versuchsskizze: s. Schülerübungen AB )
Experiment: Man erhitzt in einem Reagenzglas festes Ammoniumchlorid.
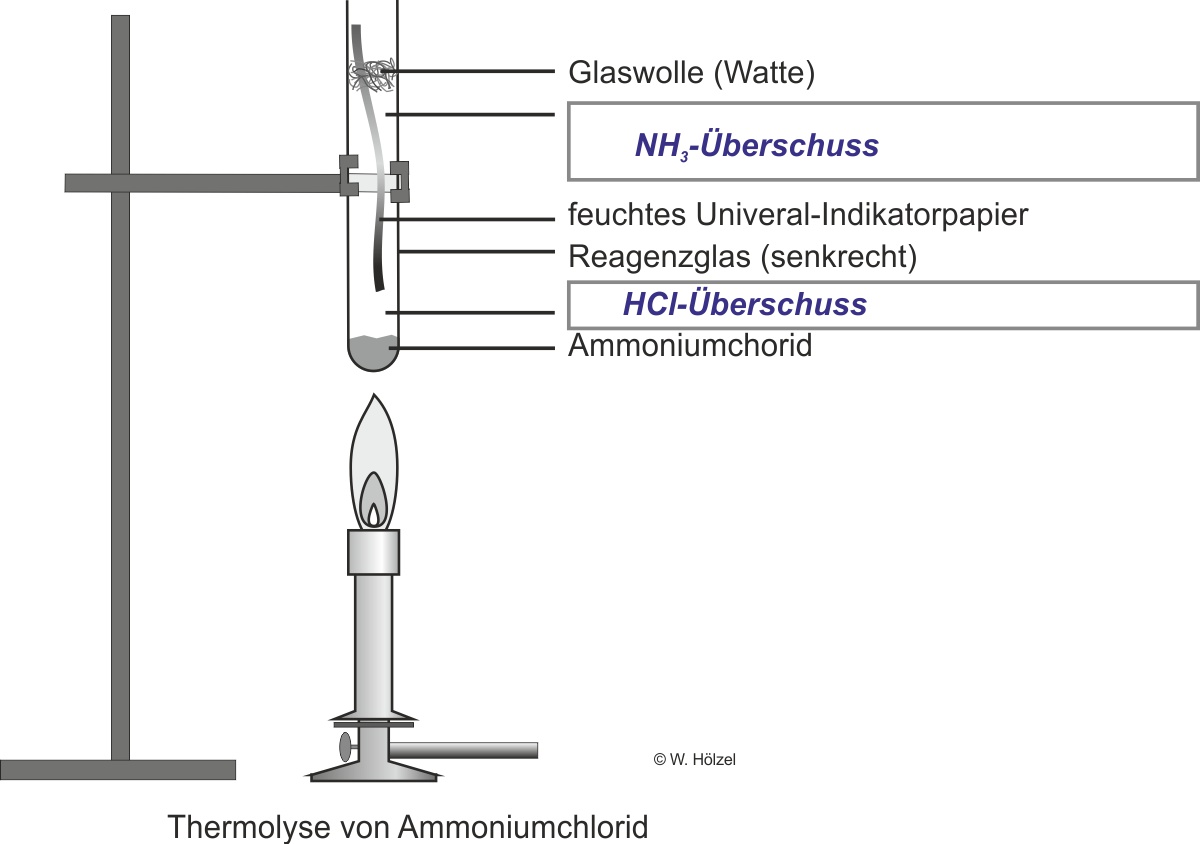
Beobachtung: das pH-Papier färbt sich sowohl rot (Hinweis einer Säure) wie auch blau (Hinweis einer Base).
Auswertung:
c) Bildung und Zerlegung von Ammoniumchlorid
NH₃ + HCl ⇌ NH₄Cl
Ammoniak Chlorwasserstoff Ammoniumchlorid
Hinweis: Die Reaktionen auf dem befeuchteten Indikatorpapier lauten:
HCl + H₂O → H₃O⁺ + Cl⁻
NH₃ + H₂O → NH₄⁺ + OH⁻
