5.1.3 Formelermittlung von Ethanol
I. Qualitative Elementaranalyse
Versuch 1: Verbrennungsanalyse
- Ethanol verbrennt zu Wasser und Kohlenstoffdioxid;
- Nachweis von CO₂: Kalkwasser (weißer NS)
- Nachweis von H₂O: Watesmo-Papier wird blau
1. Ergebnis: Ethanol enthält somit zumindest C und H.
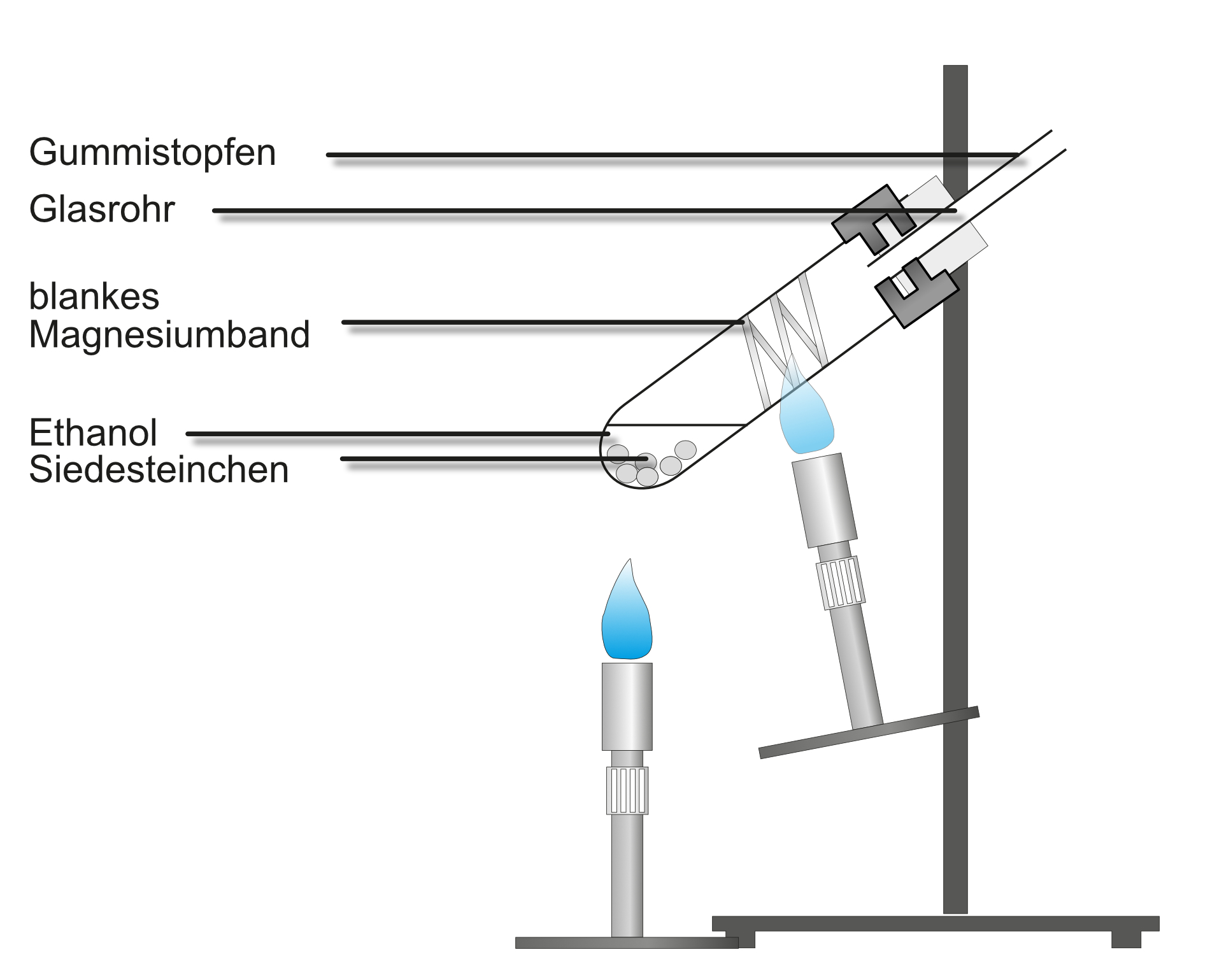
Versuch 2: Ethanol reagiert mit Magnesium - Sauerstoffnachweis
Durchführung:
- Aufbau siehe Abbildung
- Zunächst wird das Magnesiumband zum Glühen gebracht
- Danach verdampft man den Alkohol, der über das glühende Magnesiumband streicht.
Beobachtung:
Sobald Ethanol über das glühende Magnesiumband streicht glüht dieses heller auf und es bleibt ein kristalliner weißer Feststoff (Magnesiumoxid) übrig.
Ergebnis:
- Ethanol enthält neben Kohlenwasserstoff und Wasserstoff noch Sauerstoff.
II. Molekülmassenbestimmung (Verdampfungsmethode)
Hinweis: Dieser Versuch nur bei ausreichender Zeit durchgeführt. Nicht wundern, falls ihr das nicht im Heft stehen habt (dann kommt es auch in der Klausur nicht dran).
{slider title="Molmassenbestimmung nur bei viel Zeit" open="false" class="icon"}
Versuch: Molmassenbestimmung von Ethanol
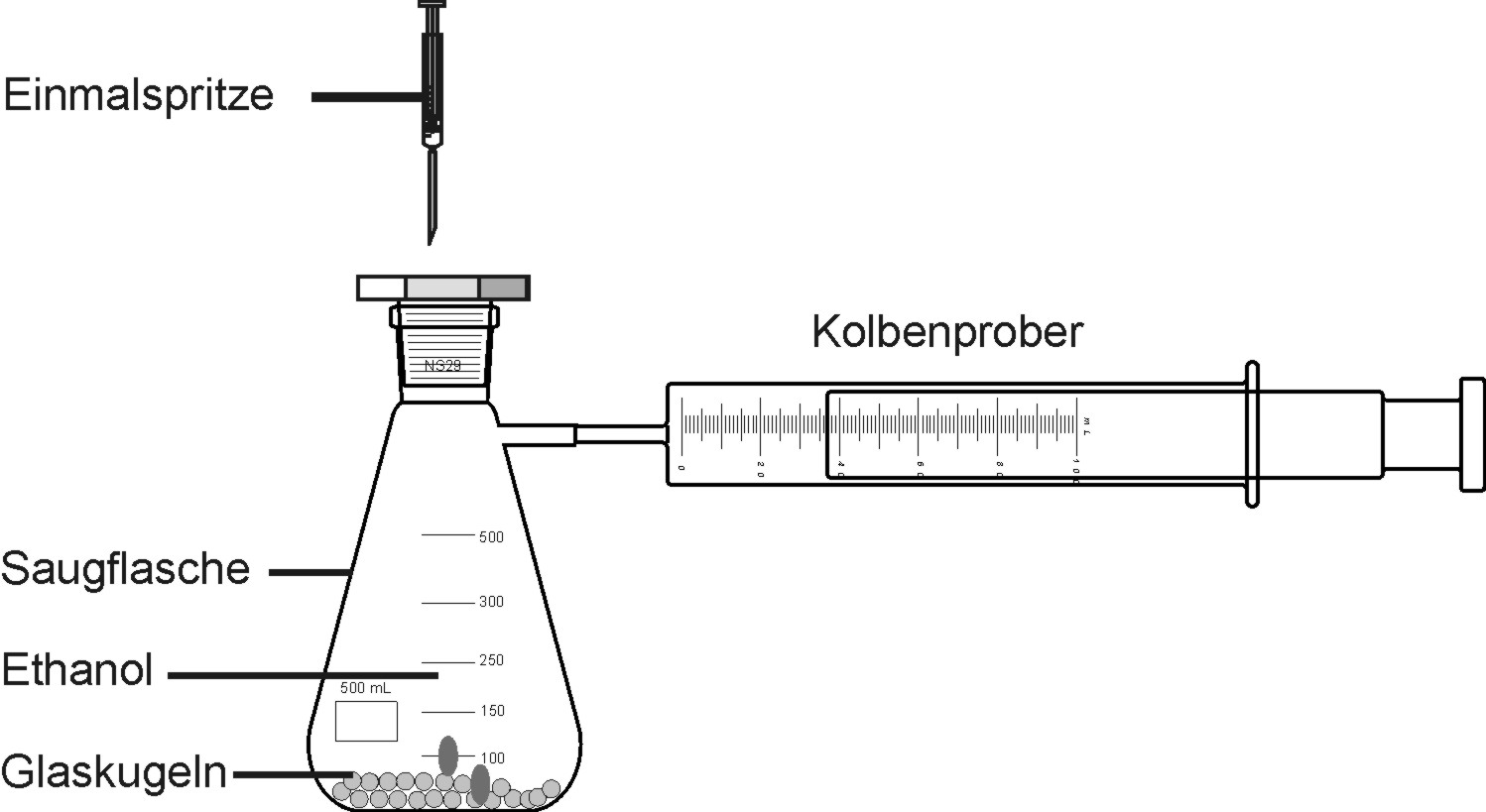
In den Erlenmeyerkolben werden 0,1 ml Ethanol eingespritzt. Auf der vergrößerten Oberfläche der Glasperlen wird das Ethanol leicht verdampft. Das entsprechende Gasvolumen kann am Kolbenprober abgelesen werden.
Auswertung:
0,1 ml Ethanol haben bei Standardbedingungen (SATP)* (25°C) ein Dampfvolumen von 43 ml.
0,1 ml Ethanol haben bei Normalbedinungen (0°C) ein Dampfvolumen von 37,8 ml.
Eingesetzte Masse Ethanol: über Dichte:
ρ = Dichte
m = Masse
V = Volumen
Rechnung:
37,8 ml Ethanol (NB) haben die Masse 0,079 g: ρ = m/V = 0,079 g/37,8 ml = 0,0021 g/ml
Über das molare Gasvolumen bei Normalbedingung Vm (Gas) = 22,4 L kann man die Molmasse berechnen.
1 mol Ethanoldampf unter NB haben die Masse:
M(Ethanol) = (0,079 g * 22 400 ml)/37,8 ml = 46,8 g (Dreisatz)
{/sliders}
Literaturwert: M(Ethanol) = 46 g/mol.
_______________
* SATP-Bedingungen (Standard Ambient Temperature and Pressure)