1. Alkane
1.1 Methan
1.1.1 Vorkommen:
im Erdgas, Sumpfgas, Biogas, Grubengas
1.1.2 Eigenschaften:
- farb- und geruchloses Gas
- geringere Dichte als Luft
- brennbar
1.1.3 Ermittlung der Summenformel (Molekülformel) und Strukturformel
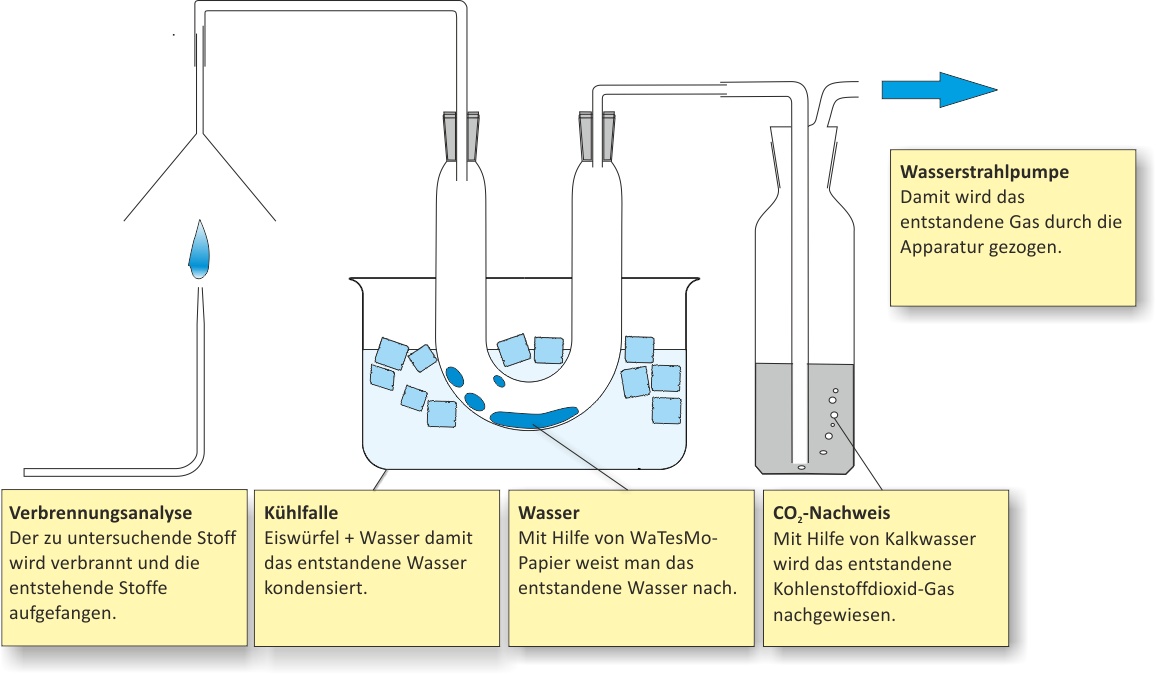
a) Qualitative Analyse (Elementaranalyse)
Hierfür wird der zu untersuchende Stoff verbrannt und die Verbrennungsprodukte werden bestimmt.
Bildet sich Wasser, wird Wasserstoff als Element vorhanden sein;
Kohlenstoff kann man einmal als Ruß (bei unvollständiger Verbrennung) oder als Kohlenstoffdioxid nachweisen. Der Kohlenstoffdioxid-Nachweis erfolgt mit der Kalkwasserprobe. Hierfür wird das entstandene Gas in Kalkwasser eingeleitet. Trübt sich die Lösung, ist Kohlenstoffdioxid vorhanden.
- Nachweis von Wasserstoff → Bildung von Wasser → WaTesMo-Papier oder wasserfreies Kupfersulfat.
- Nachweis von C → Bildung von CO2 → Nachweis als CaCO3.
Ca(OH)2 (aq) + CO2 (g) → CaCO3 (s) + H2O (l)
Die Verbrennungsprodukte (Wasser, Kohlenstoffdioxid) ergeben, dass Methan Kohlenstoff, Wasserstoff und eventuell Sauerstoff enthält
b) Bestimmung der molaren Masse
Mit Hilfe der Gaswägung kann man die Molare Masse von Methan bestimmen: M(Methan) = 16 g/mol
Molekülmasse von Methan 16 u
c) Summenformel:
Daraus ergibt sich folgende Summenformel.
CH4
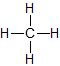
d) Strukturformel:
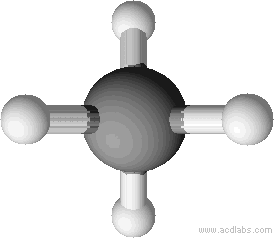
Man zeichnet Methan meist mit einem Winkel von 90°. Dieser Winkel entspricht nicht dem Bindungswinkel (vgl. unten). Man kann sich aber vorstellen, dass man direkt auf das Molekül wie in der zweiten Abbildung dargestellt wird, blickt.
Tetraedrische Anordnung der Wasserstoffatome um das Kohlenstoffatom (Bindungswinkel 109,5 °).
Erklärung: Größtmögliche Entfernung der Wasserstoffatome.
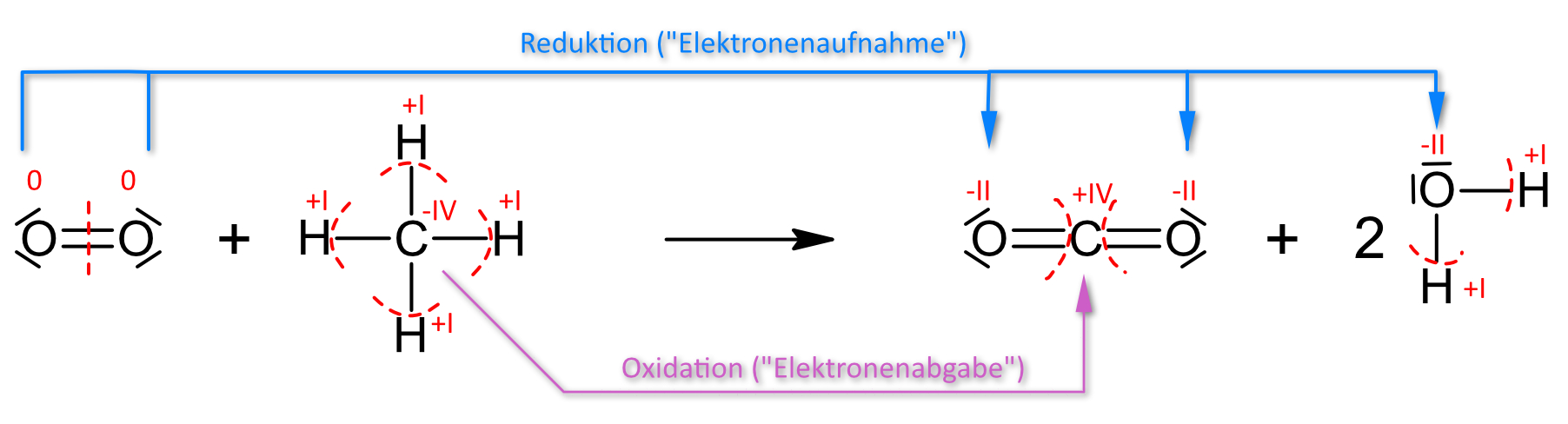
1.1.4 Vollständige Verbrennung:
0 -IV +I +IV -II +I -II
2 O2 + CH4 → CO2 + 2 H2O ΔH = - 888 kJ/mol
Hinweis: Wenn die Ermittlungs der Oxidationszahlen Schwierigkeiten macht, dann kann man es hier nochmals nachlesen.
1l Methan benötigt zur vollständigen Verbrennung 10 Liter Luft (2 l Sauerstoff).